遺傳工程
基因轉殖、重組基因、基因剔除、蛋白質工程、基因改造生物、核糖核酸干擾、倫理法規
使用 CRISPR 技術清除體內的愛滋病病毒
使用 CRISPR 技術清除體內的愛滋病病毒
德州大學分子生物科學研究所馬千惠/國立臺灣大學生命科學系陳俊宏教授責任編輯
過去四年來CRISPR/Cas9基因編輯技術,被廣泛使用於基礎科學以及臨床前實驗。Cas9 酵素在引導RNA (guide RNA) 序列帶領下,可以切斷特定的基因位置,造成双股 DNA的斷裂,細胞偵測到受損的DNA會起動修補機制,可以大幅提高基因同源重組的效率,使得編輯各種細胞和器官的基因變得容易且快速。在醫學研究上,科學家們致力於應用此技術來發展具有潛能的治療方式,包括治療遺傳疾病、癌症以及感染性疾病等(1,2)。
超級野草:農業基因轉殖技術之檢討(下)
超級野草:農業基因轉殖 (Gene Transfer) 技術之檢討(下)
國立臺灣師範大學生命科學系 薛均亮
基改作物的優點看似可以解決目前日趨嚴重的糧食危機問題,但缺點總是伴隨而來,而且這些缺點並不是立即顯現,可能要經過數十年才會發現,例如
超級野草:農業基因轉殖技術之檢討(上)
超級野草:農業基因轉殖 (Gene Transfer) 技術之檢討(上)
國立臺灣師範大學生命科學系 薛均亮
基因轉殖技術是眾多生物技術當中的其中一種,主要原理是將一個體的遺傳物質(如一段DNA或一個基因)轉殖入另一個體,使後者獲得新的遺傳性狀或表現出新的產物,這種感覺就好像被病毒感染一樣,病毒將其遺傳物質送入我們的細胞內,命令細胞為病毒製作其所需的物質,而這些物質是正常情況下,細胞本身不會產生的。
單分子技術(Single-Molecule Techniques)簡介
單分子技術(Single-Molecule Techniques)簡介
國立臺灣大學分子細胞生物學所吳克韓碩士
單分子技術的特色在於個別分子的觀察。舉例來說,在傳統分生實驗中,觀察濃度 $$1~mM$$ 的樣品,$$1~ml$$ 的反應體積中就有多達 $$10^{12}$$ 個分子,所以得到的,是多個分子均值的觀察結果。
事實上,每個分子的表現都有所差異(尤其在一些快速的反應步驟或微小族群的表現),而這些差異,若是透過傳統分生技術觀察就會被掩蓋。另外,更重要的是,單分子技術可以“操縱”分子。舉例來說,依條件所需對分子施加不同的作用力,在不同的受力下分子會表現出不同的特質。利用這樣的方式,可以觀察到分子更多細微的表現。
脂肪酶在生物技術上之應用
脂肪酶在生物技術上之應用 (Applications of lipase in biotechnology)
國立臺灣師範大學生命科學系碩士生李亞翰
脂肪酶(lipase)在工業上的應用相當廣泛,其來源主要是來自種類繁多的微生物,相較於動植物酶,微生物脂肪酶的作用pH值、作用溫度以及對受質的特異性更加廣泛,有利於進行各種工業化生產,而且酵素取得也較容易,這些因素帶動了脂肪酶在各領域中的基礎和應用研究,尤其是利用蛋白質工程技術可以廣展脂肪酶的應用範圍,因此成為重要的工業用酵素之一。
在全球酵素市場,工業用酵素佔約70%,研究與醫療用約30%。根據統計工業酵素又以清潔劑的市場最大,而脂肪酶最大的商業應用領域是用來做為家庭或工業用清潔劑的添加物,目前在市面上已有數種脂肪酶商品在販售。近年來隨著生物技科的進步及酵素新功能的開發,脂肪酶已廣泛的被應用於食品、清潔劑、紡織、皮革、醫藥、造紙、廢棄油處理等。
「DNA編輯大師」張鋒與CRISPR/Cas9/Cas9基因編輯技術(下)
「DNA編輯大師」張鋒與CRISPR/Cas9/Cas9基因編輯技術(下)
國立臺灣大學醫學院生理所林世青專任研究助理
連結:「DNA編輯大師」張鋒與CRISPR/Cas9基因編輯技術(上)
以遺傳學上常使用的模式生物:黑腹果蠅(Drosophila melanogaster)為例,根據全基因體定序分析結果,推算出果蠅約有超過15000個基因(Adams et al., 2000),過去的研究方法,必須使用例如EMS突變劑、跳躍子跳躍、費時的同源互換、繁複的ZFN與TALEN等技術,花費漫長時間才有可能得到目標基因的突變株果蠅,從而分析該基因的功能特性。
然而在發展Cas9技術後,只要得知目標基因序列,即可設計並合成出專門辨認該基因的導引RNA表現載體,表現出導引RNA後,Cas9即可快速專一地作用,直接剔除該基因,研究者僅花費很短時間與精力即可得到目標基因剔除的突變果蠅,效率為前人難以望其項背。
「DNA編輯大師」張鋒與CRISPR/Cas9基因編輯技術(上)
「DNA編輯大師」張鋒與CRISPR/Cas9基因編輯技術(上)
國立臺灣大學醫學院生理所林世青專任研究助理
麻省理工學院的張鋒(Zhang Feng)教授憑藉其發展的CRISPR(Clustered, Regularly Interspaced, Short Palindromic Repeats)/Cas9(CRISPR-Associated Protein 9)系統,年僅32歲即榮獲2013年《自然》雜誌評選之年度新聞人物首位,並獲得「DNA編輯大師」之稱號(“365 days: Nature’s 10,” 2013)。
究竟這令人折服的基因編輯技術的發展過程為何呢?西元1987年時,科學家在細菌內發現一種特殊核酸內切酶,命名為CRISPR/Cas9,其會辨認外來的DNA並加以切割降解,被認為是細菌用以抵抗病毒感染的防禦機制(Ishino, Shinagawa, Makino, Amemura, & Nakata, 1987; Bhaya, Davison, & Barrangou, 2011),若能在病毒感染的第一時間內就將其DNA降解,即可有效阻止病毒複製。
定位突變
定位突變 (Site-directed mutagenesis)
國立臺灣師範大學生命科學系研究助理林如愔
誘導基因突變是進行基因功能研究的基本方法之一。以往都是利用化學或是輻射方式誘導突變,但是以此種方法會造成隨機突變,無從預測或控制突變產生的位置。1978年Michael Smith藉由聚合酶連鎖反應(polymerase chain reaction, 簡稱PCR),以特定引子在DNA特定的位置產生突變。Michael Smith因此在1993年與PCR技術的發明者共同獲得諾貝爾獎。
下列以最為廣泛使用的Stratagene公司所發展的QuikChange點突變產品來說明定位突變的操作原理:
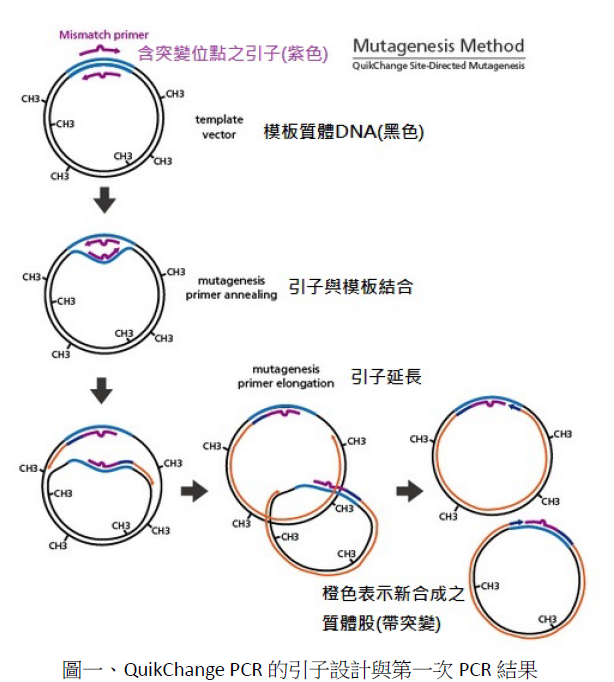 1.首先,設計一對25~45鹼基對的引子,將欲突變之位點盡可能地置於正中央,在引子的兩端最好是G或是C以加強引子配對的正確性。以此引子對與模板質體進行兩次PCR反應之後得到如圖二的不同序列組合質體。其中新的DNA序列不是在細菌體內合成,因此不具有甲基修飾;而原來做為模板的質體,因為是由細菌體內得到,故其序列含有甲基修飾。
1.首先,設計一對25~45鹼基對的引子,將欲突變之位點盡可能地置於正中央,在引子的兩端最好是G或是C以加強引子配對的正確性。以此引子對與模板質體進行兩次PCR反應之後得到如圖二的不同序列組合質體。其中新的DNA序列不是在細菌體內合成,因此不具有甲基修飾;而原來做為模板的質體,因為是由細菌體內得到,故其序列含有甲基修飾。
2.接著利用可專一性針對甲基化鹼基進行單股切割的DpnI酵素對PCR產物進行切割(見圖三)。此時只有來自於細菌、帶有原始序列的質體股會被切割,從而確保了所得的PCR產物皆含有欲得到之點突變序列。
3.之後將此突變質體送入宿主細胞進行放大或表現,即可進行特定基因功能之研究。
對於基因功能的研究,可以粗略的分為Gain-of-Function與Lost-of-Function兩大類。傳統的隨機突變與片段缺失(deletion)的方式屬於Lost-of-Function的研究手法,藉由觀察破壞基因序列的突變所導致的功能缺陷來推測該基因的功能。隨著分子生物學與蛋白質體學的發展,我們了解一個蛋白分子中可能分別含有不同功能的區塊。整個基因的缺失或是發生在該基因內的隨機突變雖然都可能造成此基因巨觀上的功能喪失,但在微觀上的成因和其機制上的影響、修補的機制都不同。因此,定位突變可以在不影響整體蛋白質結構的狀況下,分別研究蛋白質細部各胺基酸所扮演的角色。如圖四所示,此為一DNA聚合酶的立體構造,在不同位置上進行定位突變產生不同的突變蛋白。觀察其蛋白質功能的差異,可以總結分析其蛋白質不同區段所擁有的功能。利用這樣的技術與所得到的知識,可以在生物工程上加以應用,改造現有的基因產物,使其更能符合我們的需要。
定向演化(Directed evolution)
定向演化(Directed evolution)
國立臺灣師範大學生命科學系研究助理鄭杏倩
定向演化(directed evolution)是改造蛋白質分子的一種有效策略,利用在活體外(in vitro)進行實驗,將帶有目標蛋白質的基因序列進行類似天擇的選汰作用(natural selection),使之獲得在自然天擇狀況下無法得到、且具有特殊功能的基因產物。此種操作技術主要應用於蛋白質工程(protein engineering)的實驗中。
實驗操作上,先建立起一個經過隨機(randomized)突變或是重新組合的基因庫(library),接著篩選(screen/selection)出可以轉錄/轉譯出所需要功能的蛋白質之基因序列。詳細的操作方式主要有以下三個步驟:
- 多樣化(diversification):利用error-prone PCR或是DNA shuffling…等方式將目標蛋白質的基因序列進行隨機的突變(點突變point mutation、插入insertion或是刪除deletion)或是重組(recombination),得到一個具有大量且多樣性高的基因庫。
- 選汰(selection):接著,將上述的基因庫中的突變體(mutant/variant)進行蛋白質表達。篩選的方式很多樣化,目的是要篩選出具有特定功能之基因序列,並同時刪除其餘的序列。
- 放大(amplification):將目標突變體基因放大並進行複製,並對該突變體進行研究。
以上三個步驟為一個單位,上一輪選出來的突變體被拿來進行下一輪實驗的DNA模板(template),經由重複幾輪的實驗後,得到具有良好功能基因。此技術常應用在protein-ligand binding、提高蛋白質穩定性以及修改酵素結構等研究領域,並且應用在癌症藥物開發、生質燃料(biofuel)轉換等議題上。

.jpg)