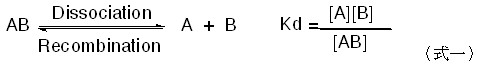三種利用依數性質求分子量方法的比較(上)
三種利用依數性質求分子量方法的比較(上)
國立臺灣師範大學化學系兼任教師邱智宏
高中化學課程介紹依數性質(colligative properties)時,總會提到利用溶液的沸點上升法(ebullioscopy)、凝固點下降法(cryoscopy)及滲透壓法(osmometry)等三種方法,來量測非揮發性溶質的分子量。
雖然前二種方法在現今的實驗室已經鮮少使用,但在化學史的介紹及公式的推導上,仍有其存在的價值。儘管此三種方法在使用上均有其共同的限制,必須在稀薄的溶液中方能適用。唯在實際的操作上,利用滲透壓法求非揮發性溶質的分子量,其準確度要比前二者高,本文分為(上)、(下)二篇,(上)篇試著經由滲透壓法公式的推導,讓讀者了解其使用上的限制,及其原因為何?(下)篇以實際的例子比較三者在實際測量溶質分子量時,何者較優。