熱力學
熱力學定律、焓、熵、自由能
反應焓的聯想(二)
反應焓的聯想(二)(Thoughts on reaction enthalpy (II))
國立臺灣師範大學化學系兼任教授 邱智宏
連結:反應焓的聯想(一)
現以溫度為 298.15 K 時由氫氣及氧氣生成 $$1$$ 莫耳水蒸氣為例,說明如何求出其標準莫耳反應焓,並藉以釐清反應焓、生成焓及相對焓的異同。
$$\displaystyle\mathrm{H_{2(g)}}+\frac{1}{2}\mathrm{O_{2(g)}}\rightarrow \mathrm{H_2O_{(g)}}~~~~~~~~~(5)$$
一般定義一莫耳純物質若由其成分元素經反應化合而成,則其焓的變化量稱為該物質的莫耳生成焓。
反應焓的聯想(一)
反應焓的聯想(一)(Thoughts on reaction enthalpy (I))
國立臺灣師範大學化學系兼任教授 邱智宏
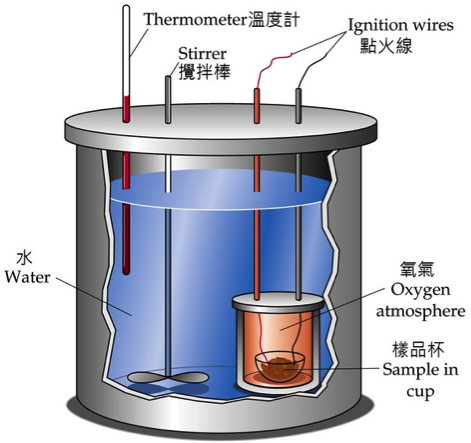
初學反應焓 (reaction enthalpy) 時經常會產生一些迷惑,首先既然已經有內能 (internal energy, U) 的狀態函數,為何還要增加一個焓 (H) 的狀態函數呢?接著反應熱和反應焓的關係為何?它們是同義詞,還是部分相等,差別在那裏?標準莫耳反應焓 ) 的定義為何?有何重要性?一個物質的莫耳相對焓和莫耳生成焓有何關聯性?最後反應焓除了使用卡計測量以外,有没有其他求法?本文擬以簡單的實例做說明,對上述疑惑做一深入淺出的說明,期盼初學熱力學的學子能有清晰的概念,及紮實的基礎。
標準莫耳生成焓與相對熵的求法(下)
標準莫耳生成焓與相對熵的求法(下)(How to calculate standard state molar formation enthalpy and conventional molar enthalpy (III))
國立臺灣師範大學化學系兼任教授 邱智宏
上列敘述看起來有一點抽象,現以恒溫、$$1~bar$$ 下進行下列反應為例:
$$\mathrm{H_{2(s)}}+\mathrm{\frac{1}{2}O_{2(s)}}\rightarrow\mathrm{H_2O_{(s)}}$$
其熵的變化可表示為:$$\Delta S=S^\circ_m(\mathrm{H_2O})-S^\circ_m(\mathrm{H_2})-\frac{1}{2}\times S^\circ_m(\mathrm{O_2})$$,當我們選擇此恒溫為極接近 $$0~K$$ 時,因為 $$(4)$$ 式為 $$0$$,故上式等號左邊的 $$\Delta S$$ 為 $$0$$,等號右邊「元素」的熵,$$S^\circ_m(\mathrm{H_2})$$、$$S^\circ_m(\mathrm{O_2})$$ 為 $$0$$,因此 $$S^\circ_m(\mathrm{H_2O})$$ 亦為零。
標準莫耳生成焓與相對熵的求法(中)
標準莫耳生成焓與相對熵的求法(中)(How to calculate standard state molar formation enthalpy and conventional molar enthalpy (II))
國立臺灣師範大學化學系兼任教授 邱智宏
另外,要求得化合物的標準莫耳生成焓 $$(\Delta_f H^\circ_{m,T})$$,事實上不只使用卡計一個步驟,其實要經過下列 $$6$$ 個相關的步驟:
標準莫耳生成焓與相對熵的求法(上)
標準莫耳生成焓與相對熵的求法(上)(How to calculate standard state molar formation enthalpy and conventional molar enthalpy (I))
國立臺灣師範大學化學系兼任教授 邱智宏
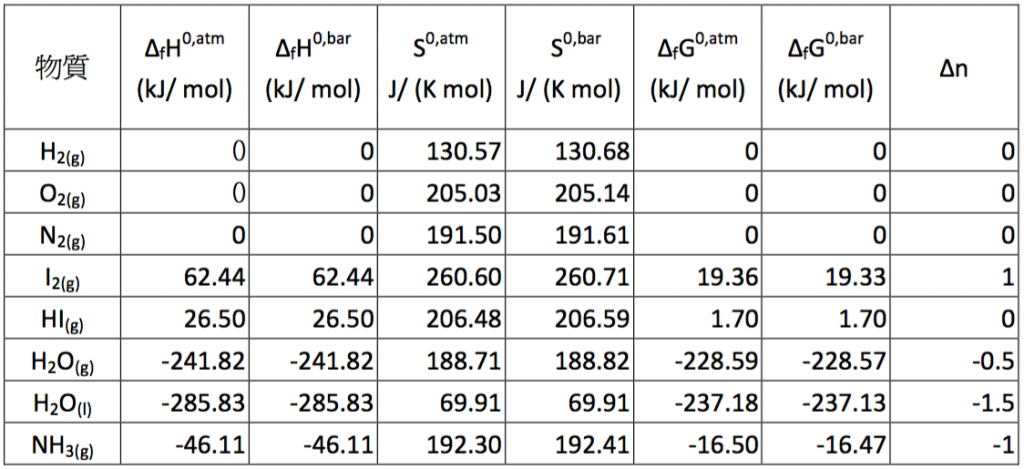
處理大部分化學熱力學的問題時,純物質的焓 (enthalpy)、自由能 (Gibbs free energy) 及熵 (entropy) 是經常被使用到的數據,因此一般化學教科書均會將一些常見物質的相關數據,表列在附錄中,以供參考及使用,如圖一所示。
但是這些數據是如何求得的?卻鮮少被討論,尤其表中純物質的焓,均以標準莫耳生成焓 (standard state molar formation enthalpy) 列表,而非使用莫耳相對焓 (conventional molar enthalpy),而熵的部分則正好相反,使用標準莫耳相對熵列表,而不是莫耳生成熵,它們真正的原因為何?本文擬以重點、大綱式的說明表列數據中焓及熵的求法,並說明選擇使用莫耳生成焓及莫耳相對熵列表的原因。
自發性反應的迷失(下)
自發性反應的迷失(下) The misconception of spontaneous reaction (II)
國立臺灣師範大學化學系兼任教授 邱智宏教授
連結:自發性反應的迷失(上)
二、碳酸水溶液中的反應
上面的例子發生在家庭的藥箱裏,接下來轉到廚房的冰箱中最常看到碳酸飲料,為了簡化討論,將添加的色素、香料及甜劑均排除,僅探討碳酸水溶液,即將 $$\mathrm{CO_2}$$ 溶在水中的反應。儘管 $$\mathrm{CO_2}$$ 溶在水中後會有微量的碳酸、碳酸氫根及氫離子產生如下:
$$\mathrm{CO_{2(aq)}+H_2O_{(l)}\rightleftharpoons H_2CO_{3(aq)}\rightleftharpoons H^+_{(aq)}+{HCO_3}^-_{(aq)}}$$ (式-3)
自發性反應的迷失(上)
自發性反應的迷失(上) The misconception of spontaneous reaction (I)
國立臺灣師範大學化學系兼任教授 邱智宏教授
在普通化學的課本中經常提到:一個化學反應的自由能變化量 $$(\Delta G)$$ 若小於 $$0$$ 時,則稱此反應為熱力學上能「自發性」反應的方程式(a thermodynamically spontaneous chemical reaction),反應有利於往生成物的方向移動。
但是此一自發性(spontaneous)的名詞,常造成學生認知上的迷失,誤認為這類反應不需外力的引導便能「即刻」的進行,事實上,生活四周便有許多反應的自由能小於 $$0$$,而反應物卻仍能穩定存在而不發生變化,有學者稱此類反應為動力學上的偏穩態(kinetically metastable),若無適當的誘因引發下,則此類反應仍能維持不反應,因此 $$\Delta G<0$$,僅為反應能即刻發生的條件之一,本文以大家耳熟能詳的雙氧水溶液及碳酸飲料為例,說明此二者均為動力學上的偏穩態,並澄清自發性反應並不一定能立即反應的概念。
標準狀態的基準壓力改變時對熱力學數據的影響(二)
標準狀態的基準壓力改變時對熱力學數據的影響(二)
The effect on thermodynamic data when the standard pressure changed (II)
國立臺灣師範大學化學系兼任教師 邱智宏
由上表可知,若非作精密計算,基準壓力小幅的改變,對莫耳生成自由能的差異,其實影響甚小。表三中物質的熱力學數據是以 $$1~atm$$ 做為標準壓力,再經公式轉換成以 $$1~bar$$ 為基準,若將此計算得出的數值,直接和物化教科書3上相對應的查表數值相互比較,其相對熵的部分計算值和查表值相差不到萬分之 $$2$$,至於莫耳生成自由能的部分,也小於千分之 $$2$$,基本上若考慮不準度的因素,兩者實際上是相等的,因此上述公式的推導是合乎邏輯的。
標準狀態的基準壓力改變時對熱力學數據的影響(一)
標準狀態的基準壓力改變時對熱力學數據的影響(一)
The effect on thermodynamic data when the standard pressure changed(I)
國立臺灣師範大學化學系兼任教師 邱智宏
定義標準狀態 (standard state) 時,首先必須訂定基準壓力,以往的壓力均訂為大家所熟悉的 $$1$$ 大氣壓力 $$(1~atm = 101,325~Pa)$$。但自 1982 年起,國際純化學與應用化學聯合會 (IUPAC) 將其改訂為 $$1~bar (10^5~Pa)$$。其所持的理由為帕 $$(Pa)$$ 為國際標準單位 (SI unit),目前已廣為各國科學界所使用;在處理平衡常數時,常使用到對數的關係式:$$\ln(p/p^0)$$,若 $$p^0=1~bar$$ 時,使用上甚為方便。
然而,在許多化學教科書上,仍沿用舊制,其拒抗的原因除了因循習慣以外,對於初學壓力的學子,一大氣壓相較於 $$1~bar$$ 是一個較為具體、不抽象的概念。可喜的是目前國內的高中化學教科書,自 95 課綱後,已經開始逐漸調整中1。
本文擬探討壓力由 $$1~atm$$ 改為 $$1~bar$$ 時,對於熱力學的數據 (thermodynamic data) 究竟有多大的影響,尤其是查表經常會使用到的 $$\Delta_f H^0$$、$$\Delta_f G^0$$、$$S^\circ$$ 及平衡常數 $$(K)$$ 等數值,並提供它們在二種不同壓力系統間的轉換方法。