化學示範實驗:利用魯米諾偵測血液(Using the Luminol Test to Detect Blood)
化學示範實驗:利用魯米諾偵測血液(Using the Luminol Test to Detect Blood)
國立彰化師範大學化學系學生葉明蕙/國立彰化師範大學化學系楊水平副教授責任編輯
前言
魯米諾化學發光反應是刑事鑑定人員檢測血液在犯罪現場的殘留痕跡所用的方法之一。在這個示範實驗中,混合魯米諾、過氧化氫和氫氧化鉀在噴霧瓶中,噴灑魯米諾溶液在可能會有血液的地方。由於血液裡的血紅素含有鐵離子可當作催化劑,使魯米諾發光,因此當魯米諾噴灑在有血液的地方會放出藍色螢光。
示範實驗影片
請按此連結:利用魯米諾偵測血液(Using the Luminol Test to Detect Blood),YouTube。
示範步驟
一、示範前準備
1. 取0.2 g的魯米諾、1.5 g的氫氧化鉀和25 mL的蒸餾水倒入一個小燒杯中,再以玻棒均勻攪拌,配置成魯米諾貯存溶液,如圖一的左邊小燒杯所示。
圖一 最左邊小燒杯內為魯米諾貯存溶液
2. 取10 mL的魯米諾貯存溶液和10 mL的過氧化氫溶液(圖一的左邊和中間小燒杯)倒入一個小燒杯中,以玻棒均勻攪拌(此溶液稱為魯米諾混合溶液)。以漏斗倒入魯米諾混合溶液到一個噴霧瓶內。
二、正式示範
1. 事先準備好下面的溶液和器材:沾染血液的布料(或衛生紙、面紙),以及含魯米諾混合溶液的噴霧瓶、鐵氰化鉀溶液、漂白水。找一間有遮光的教室或暗室,攜帶這些溶液和器材到你上課的地點。
2. 用磁鐵條壓一塊布料(或一張衛生紙、面紙)在黑板上,用滴管滴數滴的鐵氰化鉀溶液,如圖二所示。然後噴灑魯米諾混合溶液到布料上,觀察產生藍色螢光的情形,如圖三所示。關掉燈光,繼續噴灑溶液,觀察變化的情形,如圖四所示。
圖二 鐵氰化鉀溶液滴於衛生紙上
圖三 噴灑魯米諾混合溶液在鐵氰化鉀溶液上
圖四 在暗房中觀察產生藍色螢光的情形
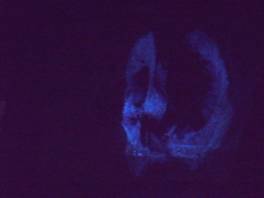
3. 用磁鐵條壓一塊沾染血液的布料(或一張衛生紙、面紙)在黑板上,如圖五所示。關掉燈光,噴灑魯米諾混合溶液,觀察產生藍色螢光的情形,如圖六所示。
圖五 一塊沾染血液的衛生紙
圖六 在暗房中觀察血液產生藍色螢光的情形
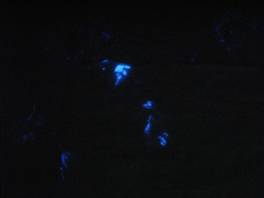
4. 用磁鐵條壓面紙(或一張衛生紙、布料)在黑板上,噴灑噴霧罐內溶液到面紙上,如圖七所示。關掉燈光,用滴管滴數滴的漂白水,觀察產生藍色螢光的情形,如圖八所示。
圖七 滴漂白水在含有魯米諾混合溶液的衛生紙上
圖八 在暗房中觀察漂白水滴在魯米諾混合溶液的情形
溶液和器材
1. 魯米諾(Luminol) 0.2 g
2. 2氫氧化鉀(Potassium hydroxide)
3. 蒸餾水 25 mL
4. 双氧水(3% H2O2) 10 mL
5. 血液(可用豬牛羊的血水,豬血湯的豬血亦可) 數滴
6. 鐵氰化鉀(Potassium ferricyanide, K3[Fe(CN)6])溶液 數滴
7. 漂白水(約3-6% 次氯酸鈉,sodium hypochlorite (NaClO)) 數滴
8. 燒杯(100 mL) 3個
9. 玻棒 1支
10. 漏斗 1個
11. 噴霧瓶 1瓶
12. 滴管 2支
13. 布料、衛生紙或面紙 少許
原理和概念
● 在魯米諾化學發光的反應中,魯米諾必須先被氧化劑活化。活化劑通常使用過氧化氫(H2O2)和氫氧化物的混合水溶液。如果碰到含鐵化合物會催化過氧化氫,使過氧化氫分解成氧氣和水:2H2O2 → O2 + H2O,並且釋放大量的能量。
● 在實驗室中,所使用的催化劑通常是鐵氰化鉀K3[Fe(CN)6];在法醫檢測中,是血紅素中的鐵離子當作催化劑,而在各種生物系統中的酶也可催化使過氧化氫分解。
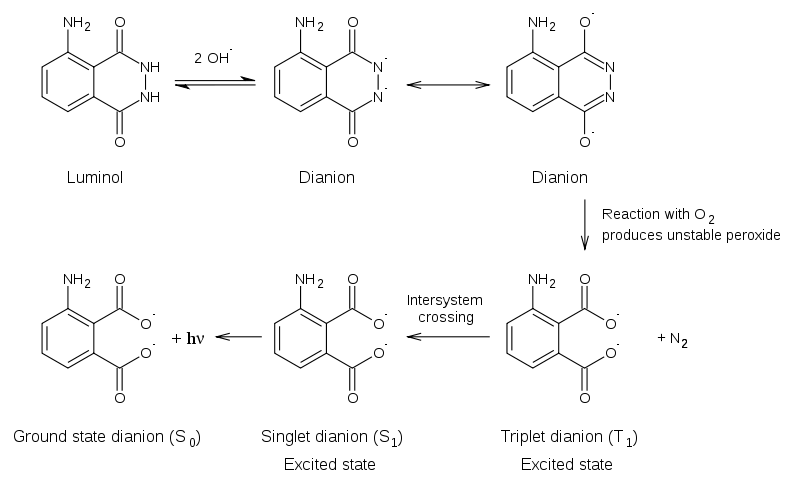
● 魯米諾化學發光的反應過程如下圖九所示:魯米諾(Luminol)與氫氧化物反應而形成雙價陰離子(dianion)。再者,過氧化氫分解所產生的氧氣(O2)與魯米諾雙價陰離子作用而生成非常不穩定的有機過氧化物(unstable organic peroxide)。有機過氧化物很快地被分解產生氮氣(N2)、3-氨基苯二甲酸(3-aminophthalic acid)和激發態的電子(excited state dianion, S1 and S2)。當激發態釋放能量回到基態(ground state dianion, S0)時,多餘的能量會以光子(hν)形式釋放,發出可見的藍色螢光。
圖九 魯米諾化學發光反應過程
圖片來源:Wikipedia, http://en.wikipedia.org/wiki/Luminol
● 魯米諾化學發光法檢測血液,是根據在鹼性的雙氧水中的血紅蛋白裡的過氧化物之活性。然而,這個檢測是受遭到強氧化劑(如漂白水中的次氯酸鈉),某些過渡金屬離子(如銅離子),和真正的過氧化物酶的干擾。這些化學物質的存在犯案發現場會影響血液測試,需要使用不同測試血液痕跡的方法。
教學提示
1. 示範這個實驗,教師應事先配製魯米諾和過氧化氫的混合溶液,並倒入噴霧瓶中備用;沾染催化劑(例如:血液)的布料、衛生紙或面紙也應事先準備好。強烈建議:使用的布料顏色與催化劑顏色相近,如此一來,原本看不出任何端倪的布料、衛生紙或面紙在混合液反應後,產生的化學發光才能製造出驚奇的效果。
2. 在示範這個實驗時,在光線明亮處較不易觀察到發光現象,建議關掉所有照明,拉上窗簾,以便更清楚的觀察到發光現象。
3. 雖然這是一個化學示範實驗,教師也可以改成有趣的化學實驗,讓學生親自動手做。建議教師可以準備多種不同的化合物,讓學生測試魯米諾和過氧化氫的混合溶液與哪些化合物反應會產生發光現象。
4. 以噴霧罐噴灑時,需注意桌面、衣物等物體表面,魯米諾溶液對它們是有害的。勿飲用魯米諾溶液,亦勿碰觸皮膚或眼睛。
5. 提醒示範者:現場演示示範實驗所展現的變化現象的臨場感,以及激發互動討論的教學效果,比單純的播放影片好很多。
6. 這個示範實驗剩餘的溶液可用合適的塑膠瓶裝妥並蓋緊,其他的溶液和器材可重複使用,最好裝在一個標示「利用魯米諾檢測血液」或放在相似主題的置物箱中備用,方便帶到教室上課。
問題和參考答案
1. 為何魯米諾和過氧化氫的混合溶液與血液反應後會發光呢?
答:魯米諾與氫氧化物反應而形成雙價陰離子。再者,過氧化氫分解所產生的氧氣與魯米諾雙價陰離子作用而生成非常不穩定的有機過氧化物。有機過氧化物很快地被分解產生氮氣和3-氨基苯二甲酸與激發態的電子。當激發態釋放能量回到基態時,多餘的能量會以光子形式釋放,發出可見的藍光。
2. 魯米諾化學發光反應中所產生的發光現象為何只能持續數十秒,而不能永久發光呢?
答:發光是因為激發態的電子躍遷回基態時,多餘的能量以光子形式釋放,而發出可見的藍光。若所有電子都已經由激發態躍遷回基態,沒有多餘的能量產生,就不會發出可見的藍光了。
安全
● 示範這個實驗必須戴安全眼鏡及可丟棄的手套。
● 示範這個實驗實行適當的風險評估是老師的責任。
參考資料
1. Luminol, Wikipedia, http://en.wikipedia.org/wiki/Luminol.
2. Luminol Chemiluminescence Test for Blood, About.com, http://chemistry.about.com/od/gl … /a/luminolblood.htm.
3. Crime Scene Chemistry-The Cool Blue Light of Luminol, http://www.sciencebuddies.org/sc … eas/Chem_p078.shtml.
4. Luminol – Chemiluminescent Blood Detector, http://www.suite101.com/content/chemiluminescent-luminol-a38625.
5. Blood Detection on a Shoe using Fluorescein, YouTube, http://www.youtube.com/watch?v=hYl8YwOdr8Q.








 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  強化玻璃
強化玻璃 
