化學實驗室實驗:結晶水的測定 – III
化學實驗室實驗:結晶水的測定 (Determination of the Water of Crystallization)〔III〕
國立臺中第一高級中學化學科楊勝凱老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
連結:結晶水的測定 – II
教師手冊 (Teacher’s Guide)
化學示範
1. 教師準備含結晶水的硫酸銅晶體(CuSO4•5H2O),展示讓學生知道為藍色晶體,如圖一所示。
2. 放置該晶體於蒸發皿中,並且以表玻璃覆蓋,用酒精燈加熱之,如圖二所示。
3. 讓學生觀察到加熱硫酸銅晶體釋放出水蒸氣,並且凝結於表玻璃上,呈現霧狀,如圖三所示。最後藍色晶體會變成白色晶體,此即為無水硫酸銅晶體(CuSO4),如圖四所示。
藥品配製
1. 0.0200 M碘酸鉀標準溶液:精稱4.28克的KIO3(莫耳質量214.001 g/mol),在定量瓶中用蒸餾水配成1.00公升。
2. 1 M硫酸溶液:用量筒取55.6 mL的濃硫酸,慢慢地倒入含約500 mL蒸餾水的燒杯中,再用蒸餾水稀釋成1升。
3. 澱粉指示劑:取3克的可溶性澱粉,加水25 mL攪勻後,緩緩地傾入500 mL的沸水中,並隨時攪拌,繼續煮沸2分鐘,靜置冷卻後,傾析取得上層澄清液,即為澱粉指示劑,本指示劑應新鮮配製,以免變質。
實驗記錄
莫耳質量:Na2S2O3:158.108 g/mol,Na2S2O3•5H2O:248.17 g/mol,KI:166.003 g/mol,Cu:63.546 g/mol,CuSO4:159.62 g/mol,H2O:18.015 g/mol。
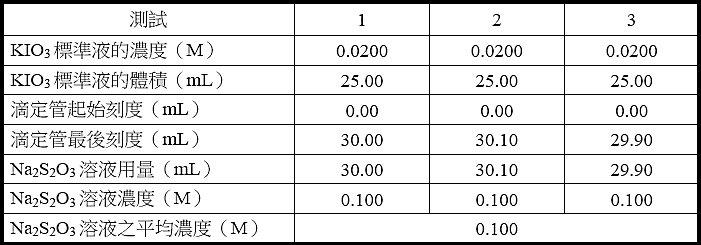
A. 標定硫代硫酸鈉溶液
KIO3標準液的濃度: 0.0200 M(由老師公佈該數值)
【註:本次實驗滴定管刻度僅初略地讀到毫升的小數點一位,未精準地讀到第二位。如此僅可得三位有效數字的Na2S2O3溶液之濃度。】
● 以測試1為例,用該數據算出硫代硫酸鈉溶液的濃度。
根據反應式[1]和[3],為了去除碘分子,反應式[1] × 1 與[3] × 3相加,得反應式[5],如下所示。
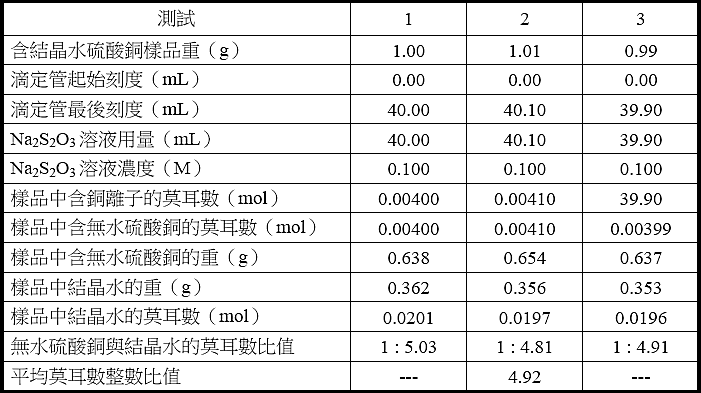
B. 測定硫酸銅粉末的結晶水含量
Na2S2O3溶液之平均濃度: 0.0100 M
【註:本次實驗滴定管刻度僅初略地讀到毫升的小數點一位,未精準地讀到第二位。如此僅可得三位有效數字的Na2S2O3溶液之濃度。】
● 以試驗1為例,用該數據算出樣品中含無水硫酸銅的莫耳數、樣品中結晶水的莫耳數以及無水硫酸銅與結晶水的莫耳數比值。
根據反應式[3]和[4],為了去除碘分子,兩反應式相加,得反應式[6],如下所示。
參考答案
1. 一開始含有I3-錯離子,其顏色為黃褐色,易於判斷,待濃度降低後,才需要指示劑協助判別,且又因為澱粉指示劑為受到硫酸的催化而分解,故較慢加入錐形瓶中。
2. 硫酸作為酸的來源,只提供H+,而硫酸根(SO42-)為非氧化劑,不會參與反應。若使用硝酸當作酸的來源,因為硝酸根(NO3–)為氧化劑,則會與還原劑硫代硫酸鈉反應,而造成硫代硫酸鈉的滴定量過高,計算得到的硫代硫酸鈉溶液的濃度值將會比實際值過低。
3. 在「標定硫代硫酸鈉溶液」的實驗中,碘化鉀為過量試劑、碘酸鉀為限量試劑。
在「標定硫代硫酸鈉溶液」的實驗中,使用移液管吸取25.00 mL的0.0200 M KIO3標準液,置於錐形瓶中,再加入約1 g 的碘化鉀。
KIO3的毫莫耳數 = 25.00 mL × 0.0200 mmol/mL = 0.500 mmol
KI的毫莫耳數 = 1 g / (166.003 g/mol) = 0.006 mol = 6 mmol
實驗使用的毫莫耳數比 = KI : KIO3 = 6 mmol : 0.500 mmol = 6 : 0.5 = 12 : 1
根據反應式[1]:5I–(aq) + IO3–(aq) + 6H+(aq) → 3I2(s) + 3H2O(l)
平衡式的毫莫耳數比 = KI : KIO3 = 5 : 1
因此,碘化鉀為過量試劑、碘酸鉀為限量試劑。
4. 因為此自身氧化還原反應速率較氧化還原滴定慢很多,故滴入的硫代硫酸鈉會先與碘反應,而無法在酸性中進行自身氧化還原反應。
5. 結晶水的n值不一定為整數,這是因為在不同溫度下,硫酸銅含結晶水的數目不同,含結晶水的硫酸銅化學式為CuSO4.nH2O之n = 1~5。含五結晶水硫酸銅在融化之前,在63℃時失去二結晶水,接著109℃時又失去二結晶水,在109℃時失去最後一結晶水。在前面兩溫度值之間,結晶水的數目可能為非整數。實驗所測得的n值為一各測量的平均值,因此n值可為小數。
參考資料和延伸閱讀
1. Copper(II) sulfate, Wikipedia, http://en.wikipedia.org/wiki/Copper(II)_sulfate.
2. Water of crystallization, Wikipedia, http://en.wikipedia.org/wiki/Water_of_crystallization.
3. Experiment to determine the number of waters of crystallisation in hydrated copper(II) sulphate, http://www.lgschemistry.org.uk/P … copper_sulphate.pdf.
4. Determining Waters of Crystallisation by Titration, http://mathsforchemistry.info/wo … ation-by-titration/.
5. Determination of the amount of water of crystallisation in hydrated sodium carbonate, http://mccscience.yolasite.com/resources/EXP 4.4.pdf.
6. Experiment 10 Hydrates, http://spot.pcc.edu/~gbackes/CH2 … Exp.10.Hydrates.htm.






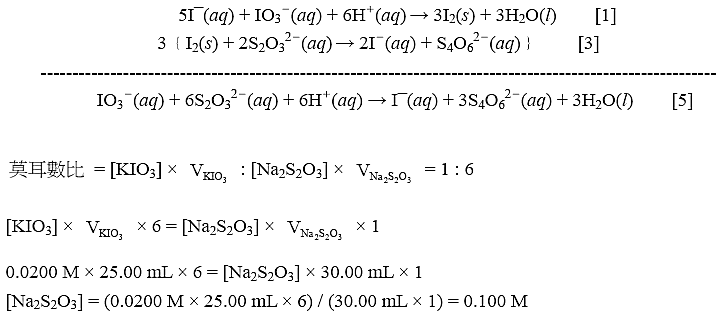

 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  強化玻璃
強化玻璃  化學的填字遊戲?
化學的填字遊戲?  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 

抱歉,剛好看到最末段,覺得有些問題…
在63℃時失去二結晶水,接著109℃時又失去二結晶水,在109℃時失去最後一結晶水。
怎麼會在109℃先失去二結晶水,又在同一溫度失去最後一結晶水?