烷類(Alkanes)(二)──化學反應
烷類(Alkanes)(二)──化學反應
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
烷類的反應性相當低。其上的氫的pKa約僅50,這代表著其上的氫極不容易解離,也就是碳──氫鍵相當穩定。所以常見烷類的反應為燃燒反應(Combustion reaction)、裂解反應(Cracking reaction),以及鏈反應或鏈鎖反應(Chain reaction)。
烷類的燃燒產生二氧化碳與水,由於涉及大量的碳─碳、碳─氫鍵斷裂,產生大量的熱,產生的熱稱為「燃燒熱(Heat of combustion)」。然而當氧氣不足時,可能產生一氧化碳與黑碳。
C5H12 + 8 O2 → 5 CO2 + 6 H2O + HEAT
C5H12 + 6 O2 → CO2 + 4 CO + 6 H2O + HEAT
C5H12 + 5 O2 → 4 CO + C + 6 H2O + HEAT
裂解反應(Cracking)則為大的烷類分子在高溫高壓,以及催化劑的作用下,分裂成較小的烷類、或較具經濟價值的烯類或炔類等分子。部份的裂解反應為鏈反應(Chain reaction)。鏈反應必須先有自由基的生成,然後自由基和烷類反應產生更多新的自由基,最後兩個自由基互相結合使得反應終止。例如一個乙烷的裂解自由基反應:
自然界中的烷類大多是透過石油的提煉、裂解、分餾而得。由於烷類的反應性低,因此其用途並不廣泛;最多的情形是做為燃料。天然氣、汽油、柴油等等,幾乎都是以烷類做為主要成分。而較長碳鏈的固體烷類,則可以做為潤滑油、瀝青等等用途。
另一個烷類重要的反應是鹵化反應(Halogenation),即烷類上的氫原子被鹵素(F, Cl, Br, I)取代的反應(Substitution reaction)。烷類的取代反應通常也是鏈反應,例如甲烷的氯化反應:
可以發現雖然起始反應需要較高的能量,能量來源可以是紫外光或加熱。由於反應中會放出大量的熱,鏈反應一經啟動反應激烈。鹵化反應的產物為混合物,包含不同程度氯取代的產物,如CH3Cl、CH2Cl2、CHCl3和CCl4,隨著使用鹵素和烷類比例的不同,主要產物也不同;氯氣過量時大量的產生CHCl3和CCl4,反之烷類為過量時產物以CH3Cl、CH2Cl2為主。
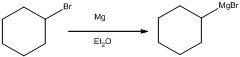
反應得到的產物鹵烷(alkane halide)是重要的有機反應起始物,例如溴化烷常用來製備有機合成當中相當常見的格林納試劑(Grignard Reagent)。
參考資料
1. Wade, L. G., Jr. Organic Chemistry, 6th edition; Pearson Education International: Upper Saddle River, 2006; Chapter 3.
2. Virtual Textbook of Organic Chemistry,Michigan State University- Department of Chemistry。 http://www2.chemistry.msu.edu/fa … rtTxtJml/intro1.htm
3. Wikipedia– Alkane http://en.wikipedia.org/wiki/Alkane
4. Wikipedia– Cracking http://en.wikipedia.org/wiki/Cracking_(chemistry)


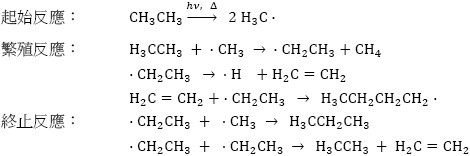
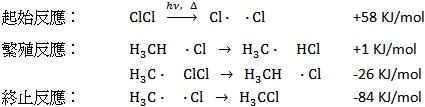
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  暖暖包的原理
暖暖包的原理  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器 

請問一下為什麼同碳數的燃燒熱是烷大於烯大於炔??
綠綠您好
您的提問經由責編回應如下:
「因為鍵能不同。炔類碳碳間為三鍵、烯類碳碳間為雙鍵,烷類碳碳間為單鍵」
管理員敬上