立方晶體
立方晶體 (Cubic Crystal)
國立臺灣大學化學系學士生黎哲豪/國立臺灣大學化學系陳藹然博士責任編輯
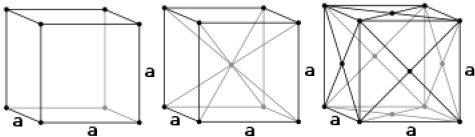
立方晶體(Cubic Crystal)是一種最基本的單位晶格(Unit cell):晶格形狀為一立方 體,為一常見之礦物晶體結構,又可區分為體心立方堆積(Body-centered cubic packing, BCC)、面心立方(Face-centered cubic packing, FCC)和簡單立方(Simple cubic packing, SC)三種。因為在立方體在三維空間中各個方向都等價,因此就光學性質、電磁性、折射率來說各個方向皆相同,具各向同性(Isotropic)。
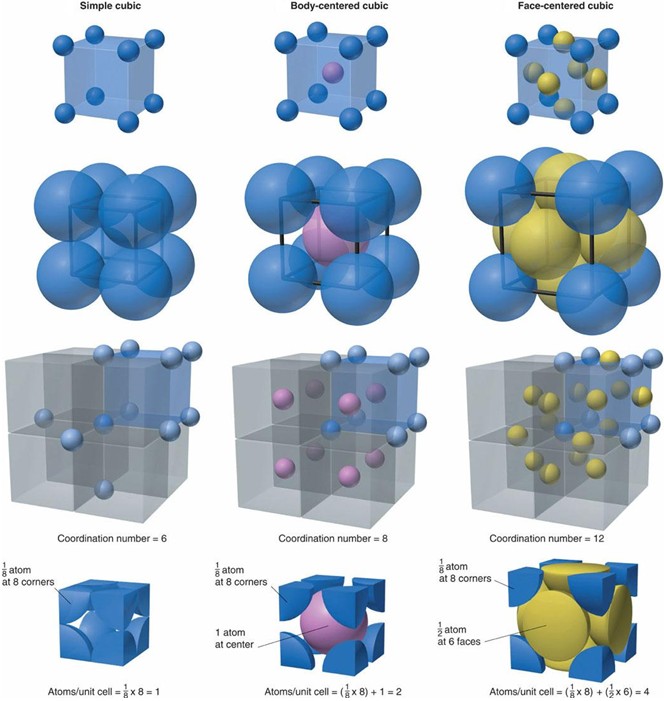
體心立方以及面心立方都是金屬常見的堆積形式,例如堆積為體心立方的有:鐵(Iron)、鉻(Chromium)、鎢(Tungsten)、鉭 (Tantalum)等,面心立方的有鎳(Nickel)、銅(Copper)、銀、金等,簡單立方堆積的金屬比較少見例如鉍(bismuth),面心立方堆積的固體具有較大的密度。
重要的立方晶體參數見表一。
如何計算每個單位晶格中的原子數,角落的原子貢獻了 \(\frac{1}{8}\) 個原子,立方體內的原子貢獻了 \(1\) 個原子,面上的原子只有 \(\frac{1}{2}\) 個原子在立方晶格內。
故以體心立方為例:
每個單位晶格中的原子數 \(=\) (角落 \(8\) 個原子 \(\times\) 在每個晶格中佔了 \(\frac{1}{8}\) ) \(+\) (中心 \(1\) 個原子 \(\times\) 在晶格中佔了 \(1\) ) \(=\) \(2\) 個原子
距離最近的原子數,又稱做配位數(coordination number),以圖一中間的體心立方為例,正中心的原子的周圍最近的鄰居即八個角落的原子,當我們把周圍其他幾個單位晶格也畫出來,會發現其他原子的距離會更遠一些。按照這個方式,也可以發現簡單立方(此時必須把周圍的單位晶格畫出來),每個原子最靠近的鄰居即上下左右前後,一共六個;至於面心立方則是要將 \(9\) 個單位晶格相疊,以其連接面中央原子為例,此原子的周圍被 \(12\) 個相鄰的原子包圍,顯示其配位數為 \(12\)。
有效占用體積比例,即原子的體積占有整個單位晶格的多少體積,以體心立方為例:
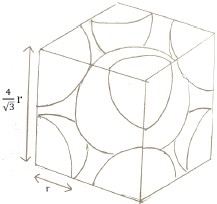
原子半徑與單位晶格邊長的關係 \(\displaystyle a=\frac{4}{\sqrt{3}}r\)
每個體心立方單位晶格有兩個原子 \(V(\text{原子})=2\times\frac{4}{3}\pi r^3=\frac{8}{3}\pi r^3\)
而總體積 \(\displaystyle V(\text{單位晶格})=a^3=\frac{64}{3\sqrt{3}}r^3\)
因此有效占用體積 \(\frac{V(\text{原子})}{V(\text{單位晶格})}\) \(\displaystyle =\frac{\frac{8}{3}\pi r^3}{\frac{64}{3\sqrt{3} }r^3}=\frac{\sqrt{3}\pi}{8}=0.680\)
如何判斷金屬或晶體以何種方式堆積可以用原子或離子半徑以及單位晶格長度來計算,進而計算出晶體的密度。反之,當我們知道晶體的密度、原子量和原子(離子)半徑時,可以推算出體晶體的堆積模式。
已知鉻(Chromium)為體心立方堆積,其單位晶格的體積為 \(2.583\times 10^{-23}~cm^3\),則鉻原子的原子半徑為?
從單位晶格的體積,我們可以得知單位晶格邊長為 \(a=2.956\times 10^{-8}~cm\)
又原子半徑與單位晶格邊長的關係 \(a=\frac{4}{\sqrt{3}}r\)
原子半徑為 \(r=1.28\times 10^{-8}~cm=1.28~\text{埃}\),與實驗值相當吻合。
若已知銅的原子半徑 \(r=1.28~\text{埃}\),而實驗上得到的密度為 \(8.93~g/cm^{3}\),那銅的堆積形式是體心立方還是面心立方?
(1) 假設是體心立方堆積
將單位晶格畫出後,根據立方體的對角線是四倍的原子半徑(注意在對角線的部分原子相切),可由畢氏定理求出單位晶格的邊長 \(a=\frac{4}{\sqrt{3}}r\)
而
\[ 密度=\frac{重量}{體積}=\frac{每個晶格的重量}{每個晶格的體積} \]
\[ =\frac{每個晶格2個原子\times 銅的分子量 \div 亞佛加厥數}{單位晶格的邊長三次方}=\frac{2M/N_A}{a^3} \]
\[ d=\frac{2M/N_A}{a^3}=\frac{2\times 63.5(\frac{g}{mol})\div (6.02\times 10^{23})}{(\frac{4}{\sqrt{3}}\times 1.28 \times 10^{-8}~cm)^3}=8.17~g/cm^3\]
與實驗值差異較大。
(2) 假設是面心立方堆積
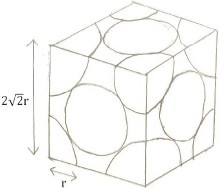
同理,將單位晶格畫出後,邊的正方形對角線為四倍原子半徑,可由畢氏定理求出單位晶格的邊長 \(a=2\sqrt{2}r\)
而
\[ 密度=\frac{重量}{體積}=\frac{每個晶格的重量}{每個晶格的體積} \]
\[ =\frac{每個晶格4個原子\times 銅的分子量 \div 亞佛加厥數}{單位晶格的邊長三次方}=\frac{4M/N_A}{a^3} \]
\[ d=\frac{4M/N_A}{a^3}=\frac{4\times 63.5(\frac{g}{mol})\div (6.02\times 10^{23})}{(2\sqrt{2}\times 1.28 \times 10^{-8}~cm)^3}=8.90~g/cm^3\]
與實驗值很接近,因此我們可以推測銅的堆積形式為面心立方堆積。
參考資料
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company:Boston, 2003; pp. 380-381.
2. Silbey, R. J. Physical Chemistry, 4th edition; John Wiley & Sons, Inc.; pp. 807, 827.
3. Wikipedia──Cubic crystal system http://en.wikipedia.org/wiki/Body-centered_cubic
4. Worksheet – Body-Centered Cubic Problems – AP level, The Chem Team. http://www.chemteam.info/Liquids&Solids/WS-bcc-AP.html



 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 

為甚麼面心立方要將9個單位晶格相疊,不是六個
18您好
責任編輯回應如下:
「相疊幾個單位晶格並不重要,能清楚觀察到面心立方的配位數是12即可。」
管理員teresa敬上
解釋得十分詳盡!!!
想請教
鑽石晶格的原子半徑與單位晶格邊長關係該如何計算