化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔IV〕
化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔IV〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊(Teacher’s Guide)
教學提示
● 上課時間:教師實驗解說:約15分鐘,學生自製微量滴定管:約10分鐘,學生自製小型電磁攪拌器:約20分鐘,學生實驗操作和數據記錄:約40分鐘。學生 數據處理和回答問題(家庭作業或課堂討論):約30分鐘。若微量滴定管和小型電磁攪拌器由教師組裝,可以節省上課時間約30分鐘。
● 本實驗可配合高二化學氧化還原滴定單元實施。學生自製微量滴定管和自製小型電磁攪拌器可以融入生活科技課程和物理課程的教學中。
● 請教師提醒學生預先以蒸餾水代替優碘溶液,以熟練自製微量滴定管的操作技巧。
● 自製小型電磁攪拌器的轉速快慢可透過調整電路中的可變電阻來完成。在滴定時,若無此攪拌器,則可以用咖啡攪拌匙或塑膠筷等當作玻棒,以手動方式攪拌滴定的溶液。
● 由於本次使用滴定的裝置並非實驗室正規的裝置,因此本實驗的精確度和準確度較低,但是若仔細地操作,則最後的抗壞血酸的含量可以得到三位有效數字。
● 本實驗的待測樣品可考慮使用市售的維他命C錠、柳橙或橘子果汁。
優碘碘分子濃度的標定
A.標定步驟
1. 使用在「學生講義三」的微量滴定步驟,取高純度的硫代硫酸鈉五水化合物,來標定優碘的碘分子之體積莫耳濃度。
2. 使用電子天平秤取0.10~0.20 g(精秤到0.001 g)硫代硫酸鈉五水化合物(Na2S2O3·5H2O),置於微量滴定裝置下方塑膠容器中,加入20滴的澱粉指示劑,並加入10-20 mL的蒸餾水。
3. 以優碘溶液滴定至開始出現深藍色且維持30秒即可。記錄所需滴定優碘溶液之體積。
4. 重複上述步驟二至三次。
5. 以計算優碘的碘分子濃度。
B.計算碘分子的濃度
以下為一次滴定的計算過程
1. 秤取硫代硫酸鈉五結晶水(Na2S2O3·5H2O)的重量:0.100 g
2. 所需滴定優碘溶液的體積:6.18 mL
3. 硫代硫酸鈉與碘分子反應為氧化還原反應,如反應式[3]所示:
I2 + 2S2O32- → 2I– + S4O62- [3]
4. 已知Na2S2O3·5H2O的莫耳質量為248.19 g/mol。
由反應式[3]得知:I2莫耳數 × 2 = Na2S2O3莫耳數 × 1
亦即,I2分子的體積莫耳濃度 × (優碘溶液的mL) / (1000 mL/L) × 2
= (一次滴定硫代硫酸鈉五結晶水的g) / (Na2S2O3·5H2O的莫耳質量) × 1
5. 經由上述計算便可求得優碘的碘分子濃度:0.0326 M
藥品配製
● 澱粉指示劑:取一小湯匙的玉米粉置於250 mL的燒杯中,加150 mL的蒸餾水攪拌,加熱至沸騰10鐘以上,使之溶解,冷卻後取上層澄清液,裝在一個塑膠瓶中。
數據記錄與處理樣本
● 記錄維他命C沖飲包的廠牌和型號:五洲生物科技的斯斯維他命沖飲包
● 記錄維他命C沖飲包包裝盒上,所記載含抗壞血酸的毫克數: 150 (mg/包),
● 配製此維他命C沖飲包的總體積(沖飲液): 100.0 (mL/包)。
● 記錄優碘的碘分子濃度:0.0326 M(由老師提供)。
● 記錄滴定的實驗數據及數據處理於表一。
表一 滴定的實驗數據及數據處理
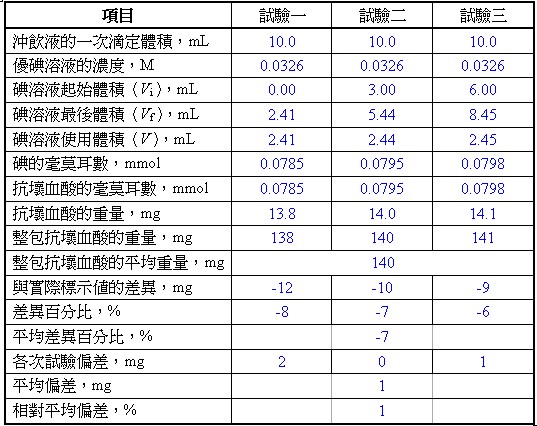 利用在當量點時,氧化劑和還原劑的當量數相等,計算維他命C沖飲包中含抗壞血酸的毫克數。
利用在當量點時,氧化劑和還原劑的當量數相等,計算維他命C沖飲包中含抗壞血酸的毫克數。
(1)計算一次滴定使用沖飲液的體積為整包維他命C沖飲液的體積的倍數。
一次滴定使用體積為整包含量的倍數 = 10.00 mL沖飲液 / 100.0 mL的沖飲液 = 1/10
(2)計算一次滴定使用沖飲液的抗壞血酸含量為整包含量的倍數。
一次滴定使用抗壞血酸含量為整包含量的倍數 = 10.00 mL沖飲液 / 100.0 mL的沖飲液 = 1/10
(3)以試驗一為例,計算一次滴定碘的毫莫耳數。
一次滴定碘的毫莫耳數 = 2.41 mL × 0.0326 mmol/mL = 0.0785 mmol
(4)以試驗一為例,計算抗壞血酸的毫克數,抗壞血酸的莫耳質量為176.14 g/mol。
一次滴定抗壞血酸的毫克數 = 0.0785 mmol × 176.14 mg/mmol = 13.8 mg
(5)計算每次滴定含抗壞血酸的毫克數之平均值。
每次滴定抗壞血酸的毫克數之平均值 = (13.8 mg + 14.0 mg + 14.1 mg) / 3 = 14.0 mg
(6)計算整包含抗壞血酸的毫克數。
整包含抗壞血酸的毫克數 = 14.0 × 10 = 140. mg
(7)整包含抗壞血酸的實驗值與實際標示值的差異及差異百分比。
兩者差異 = 140. – 150. = -10. mg
兩者差異百分比 = (-10./150) × 100% = -7%
(8)計算本實驗的平均偏差及相對平均偏差。
平均值 = (138 mg + 140. mg + 141 mg) / 3 = 140. mg
平均偏差 = (2 mg + 0 mg + 1 mg) / 3 = 1 mg
相對平均偏差比 = (1 mg /140. mg) × 100% = 1%
參考答案
1. 因為考慮微量滴定管只有10 mL的容量,所以滴定體積以不超過10 mL為原則。參考包裝盒標示維他命C沖飲包每包含抗壞血酸的毫克數為150 mg。根據理論計算,已知1 mL之優碘溶液約可與維他命C沖飲包中6.9 mg之抗壞血酸作用。若10 mL優碘溶液完全滴定完畢,最多能滴定69 mg的抗壞血酸。現考慮維他命C沖飲液的配製成100 mL的被滴定液,以一次取10.00 mL來進行此氧化還原滴定,理論上取10.0 mL維他命C沖飲液之抗壞血酸含量 = 150 mg × (10/100) = 15 mg,並未超過69 mg。
2. (1)當滴定結束時,再把三通塑膠活栓順時針旋轉90度,必須注意以免造成滴定過量。(2)有關滴定終點的判讀,需仔細觀察滴定下方塑膠容器內溶液顏色呈線深藍色且不再褪去。
3. 以數據記錄與處理樣本為例,裝盒標示維他命C沖飲包每包含抗壞血酸的毫克數為150 mg,而實驗測得整包維他命C沖飲包中含抗壞血酸的毫克數為140. mg,兩者差異為10 mg、兩者差異百分比為-7%。
此誤差來源有下面幾點可能:(1)配製已好維他命C沖飲包被滴定液,在等待及滴定過程中被空氣將其氧化,造成誤差。(2)由於維他命C沖飲包被滴定液本身有些許顏色(淡黃色),對滴定終點判定,有些許影響,因而造成誤差。
參考資料和延伸閱讀
1. Baeza, A., “Microbureta a Microescala Total para Totulometría” Rev. Chil. Educ. Cient. 2003, 12, 4-7.
2. Acid-base neutralisation – a microscale titration, http://www.practicalchemistry.or … tration,171,EX.html.
3. Determination of Vitamin C Concentration by Titration, http://www.outreach.canterbury.a … vitaminc_iodine.pdf.
4. Determination of Vitamin C, http://wwwchem.csustan.edu/chem1112/1112vitc.htm.
5. Assay of Ascorbic Acid in vitamin C tablets, http://www.pua.edu.eg/PUASite/up … t_on_Validation.pdf.
6. 化學情境試題:維他命C的定量分析(Quantitative Analysis of Vitamin C)〔I〕,http://highscope.ch.ntu.edu.tw/wordpress/?p=9867。
7. 吳柏青、郭曉怡,應用直接碘滴定法在金針乾製品二氧化硫殘留量快速檢測,宜蘭技術學報,第7期,2001,頁17-26。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  化學的填字遊戲?
化學的填字遊戲?  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  暖暖包的原理
暖暖包的原理  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
