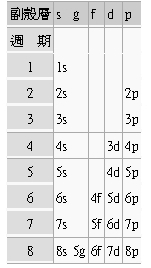
週期表的結構
週期表的結構 (Structure of the periodic table)
高雄中學化學科龔自敬老師/國立中山大學董騰元教授責任編輯
元素的化學性質的主要關鍵是它的電子組態 (electron configuration),特定的價殼層 (valence shell)電子將顯現特定的化學相似性。原子的價殼層(最外層)電子歸駐 (reside)的軌域類型決定它在週期表中的「區塊」(block);而價電子數目決定它在週期表中的「族」(block)。因為最外層的電子決定元素的化學性質,價電子的數量相同者被編入同一「族」。
在同一「族」中從最輕的元素到最重的元素,最外層電子(那些較易參與化學反應者)全部在同樣類型的軌域,具有相似的軌域形狀,但能階愈來愈高,與原子核的平均距離愈來愈遠。各主殼層被劃分成不同的副殼層 (subshells), 當原子序逐漸變大時,電子進入軌域仍須遵循「構築原理」(Aufbau principle)。
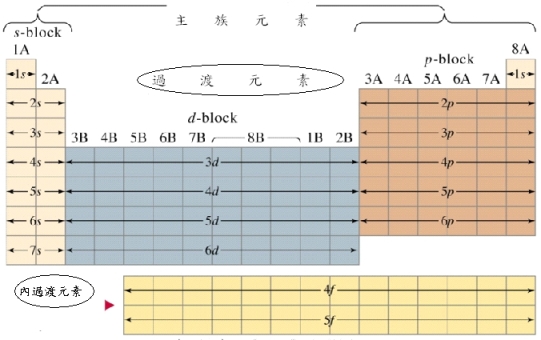
由於最外層的殼的重要性,週期表的不同的區塊有時被稱為週期表區塊 (periodic table blocks),它的命名根據「最後」 電子居住的副殼層,即s-區、 p-區、d -區和f -區等。
可分為下列三大類:
1. 主族元素 (main group elements):其價電子有1~8個,佔據著s與p軌域,所以主族元素也稱為s-區元素 (s-block elements)及 p-區元素 (p-block elements)。
2. 過渡元素(transition elements):週期表中第3~12族為過渡元素,由第四週期起,價電子填滿ns後再填入(n-1) d軌域,稱為d區元素 (d-block elements)。這些元素均為金屬,具有多種氧化態,性質較多變化。
3. 內過渡元素 (inner transition elements):包括鑭系 (lanthanide)及錒系 (actinide) 元素,這些元素均為金屬元素,其最外層電子組態涉及f軌域,稱為f區元素 (f-block elements),此區大部分元素具有放射性,且多數為人工製備。
關於元素Ununbium、 ununtrium 、ununquadium等, 它們是被發現了的元素, 但到目前為止未被命名。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  強化玻璃
強化玻璃  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  暖暖包的原理
暖暖包的原理 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應 
