緩衝容量
緩衝容量 (Buffer Capacity)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
緩衝容量,是緩衝溶液(Buffer solution)緩衝能力的指標。一般定義為緩衝溶液其pH值沒有顯著改變時(without a significant change in pH),所加入的強酸或強鹼的量。可以寫為下列式子:
其中β為緩衝容量,Ca與Cb分別為加入強酸或強鹼用於改變單位pH的濃度。而加入酸,pH是下降的;因而必須補上負號。緩衝容量越大,對抗酸鹼對溶液pH變化的能力越強。
緩衝溶液的pH值由弱酸的pKa和其弱酸與弱酸鹽的比例來決定。
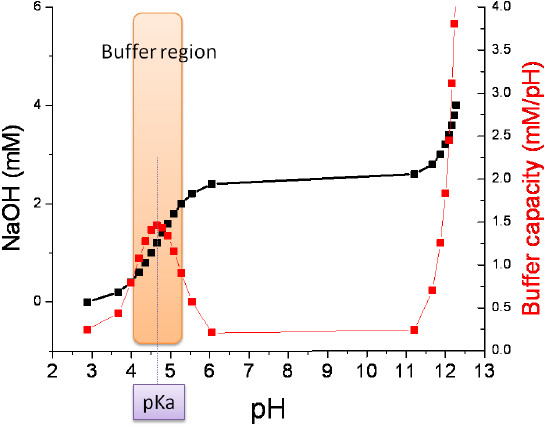
圖一為0.1 N氫氧化鈉滴定25 mL 0.1 N醋酸溶液的滴定圖,黑色曲線代表加入鹼濃度和pH的關係,紅色線為緩衝容量和pH的關係,紅色曲線為黑色曲線對pH微分的結果。從圖中可以清楚看出當 pH=pKa 時,溶液具有最大的緩衝容量。
根據式一,若 pH=pKa,
所以弱酸與其共軛鹼以1:1混合形成的時緩衝溶液可以有最好的緩衝效果。當兩者的比例差距較大時,此時較少的一方便難以再提供緩衝效果,因此其緩衝容量就會受到影響而較小。
一般而言,我們配製緩衝溶液時,所選定的pH值,會限制在該共軛酸鹼對之pKa±1的範圍之內,也就是兩者的濃度差異最多差異十倍。超過pKa±1 範圍,緩衝系統內沒有足夠的弱酸或弱鹼可以和加入的酸鹼反應,喪失了緩衝的功能。
此外緩衝溶液的緩衝容量受到緩衝溶液的濃度影響。當緩衝溶液濃度越高,緩衝能力即緩衝容量也越高。 例如0.0500 M醋酸與0.0500 M醋酸鈉混合的緩衝溶液1 L和0.500 M醋酸與0.500 M醋酸鈉混合的1 L緩衝溶液相比:
因為醋酸pKa = 4.74
混合的醋酸與醋酸鈉 pH = 4.74 + log (0.05/0.05) = 4.74
緩衝範圍為 pKa±1 ,
[A–] = 10 x [HA] 所以假設需加入鹼X mol於0.05 M緩衝 溶液,
0.05 + X = 10 (0.05 – X),X = 0.04
若緩衝溶液濃度為0.5 M時
0.5 + X = 10 (0.5 – X),X = 0.41
顯示兩者在最大緩衝範圍內所能加入的鹼的量相差了10倍,相同共軛弱酸鹼比例較高濃度的緩衝溶液具有較佳的緩衝能力與較大的緩衝容量。
參考資料
1. Harris, D. C. Quantitative Chemical Analysis, 7th edition; W. H. Freeman and Company: New York, 2007; pp. 168-171.
2. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 279-293.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  強化玻璃
強化玻璃  中間體與穩定狀態近似法
中間體與穩定狀態近似法  化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係
化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係 

若 pH=pKa,
應該是log([A-]/[HA])=0
[A-]/[HA]=1
即[HA] = [A-]
Dear WU 您好
謝謝您,經責任編輯確認已進行修正。
管理員Teresa敬上
Q. 下列緩衝液的緩衝能力有何差異?pH值有何不同?
Buffer a: 0.01 M Na2HPO4與0.01 M NaH2PO4
Buffer b: 0.1 M Na2HPO4與0.1 M NaH2PO4
Buffer c: 1.0 M Na2HPO4與1.0 M NaH2PO4
Ans. 當緩衝溶液濃度越高,緩衝能力越高。.0.1M與0.001M兩者在最大緩衝範圍內所能加入的鹼的量相差了10倍。
請問pH值有何不同?