活化能
活化能 (Activation Energy)
國立臺灣大學化學系學士生丁柏傑/國立臺灣大學化學系陳藹然博士責任編輯
活化能(Activation Energy),讓化學反應發生所需的最低能量。活化能的大小等於反應活化障壁(Activation barrier)的高度,為一實驗參數,用來描述反應速率和溫度的關係。
氫氣在空氣中點火,會立即劇烈燃燒;但是鐵椅子生鏽,卻不是一天兩天就能發生的事情。由此可以了解,不同的化學反應具有不同的反應速率,而化學家便以速率定律式(Rate law)來描述化學反應速率的大小。以速率定律式的形式為:
rate=k [A]m[B]n
其中,[A] 和 [B] 為反應物的濃度,而上頭的指數項m與n,則描述了速率隨濃度的變化程度,須藉由實驗來量測。速率定律式中的k值,稱為反應速率常數(rate constant),k值越大代表反應速率越快。影響速率常數k值的因素有很多,如:反應系統的溫度、反應物之間碰撞的頻率,以及本文所要介紹的活化能等 等。
活化能這個名詞,最早是在1889年,由瑞典化學家阿瑞尼士(Svante Arrhenius)所提出。一個化學反應要發生,首要條件就是分子之間的碰撞;然而,並非所有的碰撞皆能促使反應進行。唯有擁有足夠能量的反應物分子進 行碰撞,使得分子內原子與原子的鍵結斷裂、重新組合後,化學反應才會發生。故讓反應進行所需的最低能量稱為活化能。
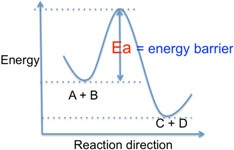
活化能,可以被想像成反應物與產物分別處於自己的最低能量狀態時,彼此間進行互相轉換的能量障礙(Energy barrier);如果無法越過這個障礙,反應便無法發生。(圖一)而反應的速率,也取決於能越過這個能量障礙的分子數目;這樣的分子數越多,反應速率也 就越快。
阿瑞尼士在提出活化能的概念時,也以物理模型與定量的數學形式,對活化能進行更完整的描述。這道被稱為阿瑞尼士方程式(Arrhenius equation)的方程式,用來描述反應速率與溫度的數學關係(式一)。
Ea便是阿瑞尼士所定義的活化能。阿瑞尼士方程式指出,反應速率與活化能、溫度之倒數皆呈現自然指數的關係。[註1]所以某化學反 應的反應速率常數的對數(ln k)與溫度的倒數(1/T)成直線關係時,表示反應符合「阿瑞尼士行為(Arrhenius behavior)」,這條直線的斜率即為-Ea/R。(圖二)
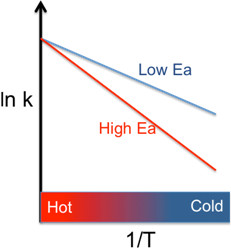 [註1] 式子中的e稱為自然指數,在數學上與圓周率一樣屬於超越數,意即它不是任何一個整係數代數方程式的解。e的近似值為2.71828。
[註1] 式子中的e稱為自然指數,在數學上與圓周率一樣屬於超越數,意即它不是任何一個整係數代數方程式的解。e的近似值為2.71828。
參考資料
1. P. W. Atkins, L. L. Jones; “Chemical Principle –The Quest for Insight”, 4th ed.; W. H. Freeman and Company, 2008.
2. WIKIPEDIA–Activation energy http://en.wikipedia.org/wiki/Activation_energy
3. WIKIPEDIA– Arrhenius equation http://en.wikipedia.org/wiki/Arrhenius_equation
4. WIKIPEDIA—e ( mathematical constant) http://en.wikipedia.org/wiki/E_%28mathematical_constant%29


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  化學的填字遊戲?
化學的填字遊戲?  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
