3D有趣實驗:瓶中精靈(Genie in the Bottle)〔II〕
3D有趣實驗:瓶中精靈(Genie in the Bottle)〔II〕
國立彰化師範大學化學系學生許紘齊 / 國立彰化師範大學化學系楊水平副教授責任編輯
原理和概念
- 催化劑(Catalyst)又稱為觸媒,在一些化學反應中,某物質既不是反應物也不是生成物,但可以改變該化學反應的速率,加速這項化學反應,稱該物質為催化劑。催化劑在反應完成後,本身的質量既不增加,也不減少。生物體中的催化劑,叫做酵素(Enzyme)。一般而言,催化劑加速反應過程具有兩個途徑,一個是增加反應物的活性中心,另一種是改變反應途徑。
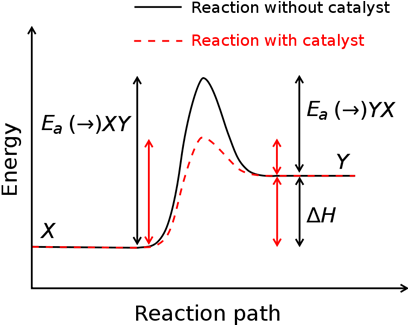
- 催化劑的定義:催化劑可參與反應但不出現在反應式中,反應前或反應後催化劑的性質和質量都不改變,不同的反應所使用的催化劑不相同,不一定每一個反應都有催化劑可以使用。催化劑的作用:催化劑就是藉著改變反應的路徑,造成不同的活性複合體(activity complex),可降低活化能(activity energy),達到催化的目的。催化劑加入反應中,同時使正反應和逆反應的活化能也降低,正反應和逆反應的速率同時加快,故不會改變化學平衡,如圖六所示。
(Reaction without catalyst,沒有催化劑的反應,黑色字體和圖形)
(Reaction with catalyst,有催化劑的反應,紅色字體和圖形)
(Reaction path,反應路徑;Energy,能量:Ea,活化能;△H,焓變化)
- 過氧化氫(H2O2,俗稱雙氧水)的催化分解反應,產生氧氣、水蒸氣、及大量的熱。在常態下,過氧化氫分解速率不快,但若加入二氧化錳(MnO2)或碘化鉀(KI)等催化劑後立即發生劇烈作用,產生大量氧氣與煙霧般的水蒸氣。此催化反應如反應式[1]所示:
2H2O2(aq) → O2(g) + 2H2O(g) + heat [1]
除了上述兩種化學藥品,一般酵母粉或紅蘿蔔亦含有酵素,可催化過氧化氫的分解,但反應較不激烈且速率慢。
- 本實驗加入碳酸鈉(Na2CO3),是為了去除反應所生成的碘(I2),碘蒸汽具有味道,聞多對身體有害。由於碘在鹼性環境(碳酸鈉溶液含OH–)中會產生自身氧化還原反應,可以避免碘蒸氣的產生。其反應如反應式[2]所示:
3I2(s) + 6OH–(aq) →5I–(aq) + IO3–(aq) + 3H2O(g) [2]
教學提示
1. 本實驗使用雙氧水,未稀釋的高濃度雙氧水具腐蝕性,配製及使用時應確實配戴手套、安全眼鏡及實驗衣。
2. 本實驗所使用的軟木塞,在實驗前應先打洞。避免「衛生紙捲」不慎掉入瓶中而發生化學反應,導致氣體冒出而酒瓶發生爆炸的風險。
3. 拔開軟木塞後可以搖晃酒瓶數下,使反應順利發生。
4. 本實驗使用的固體藥品以研缽磨至細粉末狀,實驗效果較佳
5. 本實驗亦可當作教師演示的化學示範實驗。
安全
1. 進行本實驗「瓶中精靈」必須在老師的監督下進行,也必須在戴上實驗手套、穿實驗衣和戴安全眼鏡的防護下進行。
2. 由於反應過程為放熱反應而呈現高溫狀態,反應後的酒瓶應放置一段時間後等待冷卻後才能取下。
3. 本實驗使用的雙洋水為強氧化劑,使用時應小心,使用後藥瓶應該立即塞緊。
4. 對本實驗實行適當的風險評估是老師的責任。
廢棄物處理
1. 反應後剩餘的二氧化錳及碳酸鈉,應該回收到「重金屬」廢棄桶中,不可用水沖洗而污染環境。
2. 實驗結束後,酒瓶和軟木塞應清洗乾淨,並且回收再利用。
問題與參考答案
1. 拿掉軟木塞後產生的白色煙霧是什麼?為什麼會發生白色煙霧?
答:白色煙霧是水蒸氣。在包有催化劑的「衛生紙捲」掉到雙氧水(過氧化氫)中,雙氧水會發生劇烈反應,而分解產生水和大量的熱,水吸收了大量的熱能便產生大量的水蒸氣。
2. 請問本實驗涉及哪些化學反應?請寫下這些反應式並平衡之。
答:涉及兩個化學反應,其平衡反應式如下所示:
2H2O2(aq) → O2(g) + 2H2O(g) + heat
3I2(s) + 6OH–(aq) →5I–(aq) + IO3–(aq) + 3H2O(g)
3. 承上題,這些反應是屬於氧化還原反應嗎?若是,反應式中反應物和產物的各原子的氧化數為何?針對各反應,哪一個反應物被氧化?哪一個反應物被還原?
答:兩個反應都是屬於氧化還原反應。
——————–
就2H2O2(aq) → O2(g) + 2H2O(g)而言,
H2O2:H的氧化數為+1,O的氧化數為-1。
H2O:H的氧化數為+1,O的氧化數為-2。
O2:O的氧化數為0。
由於反應物H2O2的O氧化數為-1,下降到產物H2O的O氧化數為-2,因此H2O2被還原。由於反應物H2O2的O氧化數為-1,上升到產物O2的O氧化數為0,因此H2O2被氧化。由上述可知,H2O2在此反應中屬於自身氧化還原。
——————–
就3I2(s) + 6OH–(aq) →5I–(aq) + IO3–(aq) + 3H2O(g)而言,
I2:I的氧化數為0,I–的氧化數為-1。
I2:I的氧化數為0,IO3–的氧化數為+5。
OH–:O的氧化數為-2,H的氧化數為+1。
H2O:O的氧化數為-2,H的氧化數為+1。
由於反應物I2的I氧化數為0,下降到產物I–的I氧化數為-1,因此I2被還原。由於反應物I2的I氧化數為0,上升到產物IO3–的I氧化數為+5,因此I2被氧化。由上述可知,I2在此反應中屬於自身氧化還原。
4. 請問本實驗所使用之二氧化錳和碘化鉀有何功能?
答:二氧化錳和碘化鉀在實驗中都當作催化劑。過氧化氫在常態下分解速率不快,加入二氧化錳(MnO2)或碘化鉀(KI)等催化劑後,酒瓶內立即發生劇烈作用,產生大量氧氣和煙霧般的水蒸氣。
5. 請問催化劑有何功用?
答:催化劑的功用是改變反應的路徑,造成不同的活性複合體(activity complex),可降低活化能,達到加速化學反應的目的。一般具有兩個途徑,一個是增加反應物的活性中心,另一種是改變反應途徑。
參考資料:
1. Genie in a Bottle: The Exciting Nature of Chemistry, Flinn Scientific—Teaching ChemistryTM eLearning Video Series.
2. Catalysis, Wikipedia, the free encyclopedia.
3. Hydrogen peroxide , Wikipedia, the free encyclopedia.
4. Potassium iodide, Wikipedia, the free encyclopedia.
5. Manganese(IV) dioxide, Wikipedia, the free encyclopedia.
6. Sodium carbonate , Wikipedia, the free encyclopedia.
7. 阿拉丁神燈與大象的牙膏,2007白沙化學驚奇秀,中學化學示範實驗。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名 
