酸鹼指示劑(Acid-Base Indicator)的變色原理
酸鹼指示劑(Acid-Base Indicator)的變色原理
國立臺灣大學化學系林雅凡博士/國立臺灣大學化學系李俊毅責任編輯
酸鹼指示劑無論對於判定物質的 pH值,或是應用於酸鹼滴定上,都扮演著重要的角色。早在十七世紀,人們就開始在各樣的研究上利用指示劑,然而卻遲至十九世紀末,科學家才開始對「為什麼酸鹼指示劑在不同的pH值之下會呈不同顏色?」這樣的問題有較深入地探討。最先對這現象提出解釋的,是德國化學家威廉•奧士華(Wilhelm Ostwald),後來經過漢茲許(A. Hantzsch)、科爾索夫(I. M. Kolthoff)以及史第格立茲(Julius Stiegliez, 1867-1937)等人的研究、修正與歸納後,提出現今我們所認同的酸鹼指示劑變色理論。
「決定指示劑變色的因素是什麼?」言簡意賅的說,就是「平衡」。一般常用的指示劑本身即是一種弱酸或弱鹼,所以置於溶液中,自然有微弱的解離現象產生,而能寫成如式一的平衡式。
在達到平衡的時候,此弱酸指示劑(在此以弱酸形式的指示劑為例)的平衡常數KAI可表達成如式二。
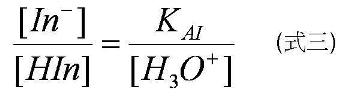
而可以作為指示劑分子的,通常具備一個基本特性,那就是弱酸(鹼)性指示劑分子(HIn)與其解離後的共軛結構(In–)所呈現的顏色是不同的。如此一來,當[H3O+“> > 10 KAI時,溶液較易表現出HIn的顏色;相反地,如果[H3O +“> < KAI/10,溶液呈色就會受In–的顏色主導。
所以理論上,若要以指示劑測溶液中的pH值,由式三,當[H3O +“>=KAI時,能測得最準確的結果,因為在此時,[HIn”>=[In–“>,溶液呈色應是兩種形式指示劑顏色混合的結果。然而實際上,指示劑的變色並非在[H3O +“>=KAI的瞬間,溶液立刻由HIn或In的顏色,變為兩者混合的顏色,乃是存在一變色範圍,在此範圍之內,溶液都會呈現混合顏色,而不易區分哪種顏色主導較多。而混合色範圍的大小,則會因指示劑分子的特性而有所不同,範圍較窄者,判讀出來的pH值越準確。
根據這樣的原理,不論是利用指示劑來判斷pH值,或是用其作為酸鹼反應滴定終點的判斷,「選擇適用的指示劑」就是一門不可或缺的功課。一般而言,我們會選擇用平衡常數為KAI的指示劑,指示在pKAI-1到pKAI+1區間的pH值。
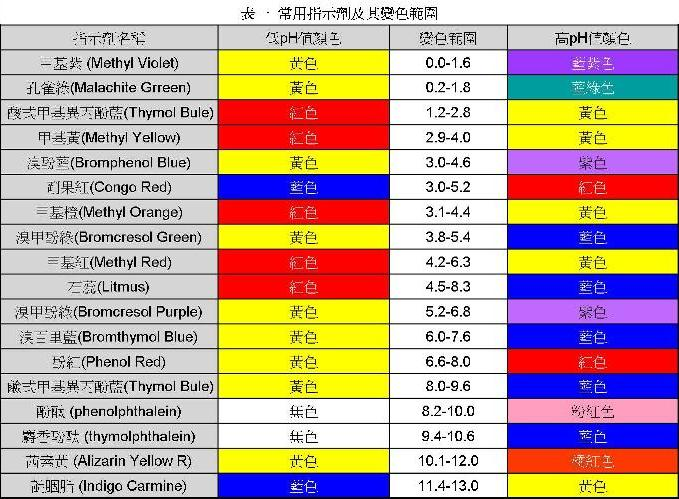
故此,了解酸鹼指示劑的變色範圍就非常重要。表一列出一些實驗室常見的指示劑及其變色範圍。
1920年後,科學家利用不同濃度比例的多種指示劑混合,企圖開始致力於發展出既能精確測出pH值,又適用於較寬廣範圍酸鹼值測定的指示劑。例如1921 年,費勒頓(Lloyd. D. Felton)將甲基紅(methyl red)/溴瑞香草酚藍(bromthymol blue)體積莫耳濃度=1:1比例混合在一起,能成功測得pH=4.6~7.6範圍的物質酸鹼值;將甲基紅/溴甲酚紫(bromcresol purple)=1:1比例混合在一起,可測得pH值範圍則為4.6~7.0;甲基異丙酚藍(thymol blue)/溴酚藍(bromphenol blue)=1:1,可測得pH範圍為1.2~4.6;甲基紅/甲基異丙酚藍=1:1則為4.6~9.0;西元1922年,李吉俄斯(J. L. Lizius)與艾維爾斯(Norman, Evers)共同提出,將甲基紅/甲基異丙酚藍體積莫耳濃度=1:3比例混合在一起,可測得pH值範圍為4.0~10.0;酚酞(phenolphthalein)/甲基異丙酚藍=1:6,可測得pH值範圍為8.0~10.0。而最終,科學家把甲基紅、酚酞、溴瑞香草酚藍、甲基異丙酚藍、麝香草酚酞(thymolphthalein)、1-萘酚酞(α-naphtholphthalein)等五種試劑混合,形成現今廣為人使用的廣用指示劑(universal indicator)。要提出來說明的,是直至二十世紀中,科學家仍持續改良廣用指示劑的成分,所以若查閱其他資料,對廣用指示劑的成分說明,或多或少會有些許不同,但最主要的幾種成分則不會有太大差異,可參閱參考文獻4。

參考文獻:
1. Kolthoff, I. M. “Acid Base Indicator” Lightning Source Inc. 2007.
2. Stiegilez, J. J. Am. Soc. Chem. 1903, 539, 1112.
3. Felton, L. D. J. Biol. Chem. 1921, 299.
4. Foster, S.F. ; Gruntfest, I. J. J. Chem. Edu., 1937, 14, 274.


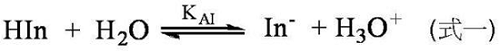
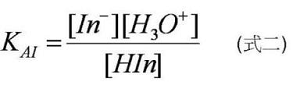
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學 
