逸散
逸散 (Effusion)
國立臺灣大學 物理博士班 97級 鄭安良
當裝有氣體分子的容器外牆有一個微小的孔洞時,容器內的氣體分子會經由這個小洞慢慢的流出容器外。如果這個孔洞非常微小,在容器內氣體分子並不會明顯被改變其原本處於平衡的狀態,此時容器內氣體分子經由此微小孔洞流出到容器外的過程,我們就稱之為逸散(Effusion)。
然而,想要發生逸散的現象,容器的孔洞必須要多小呢?
我們知道平均自由徑 $$l$$ (Mean free path)的長度大約可以看成氣體分子之間自由的移動直到發生碰撞發生之前所走的距離,當氣體分子經過孔洞附近的區域,氣體分子溢出容器時沒有相互發生碰撞,也就是孔洞的直徑 $$D$$ 要小於氣體分子的平均自由徑的長度 $$l~(D<l)$$,這就是發生逸散時孔洞大小的條件。
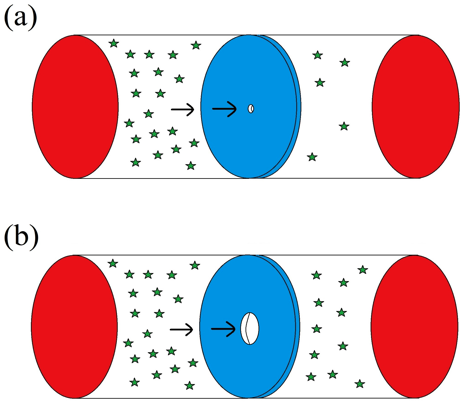
圖一 逸散現象和擴散現象的示意圖。氣體分子從容器左邊經由孔洞流到容器右邊。(a)孔洞的直徑小於氣體的平均自由徑$$(D<l)$$,為逸散現象。(b) 孔洞的直徑大於氣體的平均自由徑$$(D>l)$$,為擴散現象。(作者繪圖)
如果當孔洞大於氣體分子的直徑,此時擴散現象就會發生。圖一是逸散現象和擴散現象的示意圖。當在室溫及標準大氣壓下,氣體分子的平均自由徑 $$l$$ 約為 $$10^{-7}m$$,如果此時要形成逸散的現象,孔洞必須非常的小。我們知道平均自由徑和壓力是成反比的關係,要發生逸散的現象,平均自由徑的長度要有一個下限,也可以說壓力要有一個上限,所以逸散本質上是一個低壓的現象。
逸散在生活上有許多的例子以及應用。首先我們先來推導一下不同氣體分子的逸散率和分子質量的關係。利用氣體動力論的計算,單位時間單位面積所通過的分子數目(通量)可以表示如下:
$$\Phi = \rho \overline{v}/4~~~~~~~~~(1)$$
$$\Phi$$ 是分子通量,$$\rho$$ 是單位體積的分子數目,而 $$\overline{v}$$ 是分子的平均速度。對於理想氣體
$$PV=NkT~~~~~~~~~(2)$$
$$P$$ 是壓力,$$V$$ 是體積,$$N$$ 是分子數目,$$T$$ 是溫度,$$k$$ 則是波茲曼常數。
利用式子 $$(2)$$ 單位體積的分子數目可以表示為 $$\rho=N/V=P/kT~~~~~~~~~(3)$$
氣體分子的平均速度可以表示為 $$\overline{v}=\sqrt{8kT/\pi m}~~~~~~~~(4)$$
$$m$$ 是分子的質量
將式子 $$(3)$$ 和 $$(4)$$ 帶入式子 $$(1)$$,得到 $$\Phi=\displaystyle\frac{P}{\sqrt{2\pi mkT}}$$
由式子 $$(5)$$ 可以看出不同氣體分子的逸散率和分子質量的平方根是成反比的關係。上面的推導也可以解釋在英國蘇格蘭化學家格雷姆(Thomas Graham, 1805-1869)在 1831 年所觀察到氣體分子的逸散速率和質量的平方根成反比關係的實驗現象(格雷姆定律,Graham’s law)。
由上述的說明,我們知道質量較輕的氣體分子的逸散現象會比質量較重的氣體分子要來的快速。在生活上有一個常見的例子,一個充滿氦氣的氣球,為什麼經過一段時間後,氣球的體積會慢慢的減小呢?因為氦氣的原子量小於空氣分子的平均分子量,所以氦氣經由氣球表面上的小孔逸散到氣球外的速率會比氣球外面的空氣分子逸散到氣球內的速率還要快,如此一來氣球體積就會慢慢減小了。而上述的原理同樣的也可以解釋為什麼充滿氧氣的氣球洩氣的速度會比充滿氫氣的氣球要來的慢的原因。
逸散還有一個很重要的應用,就是分離同位素。將含有兩種同位素的混合氣體放置於一個容器內,容器表面上的小孔允許容器內的混合氣體逸散至容器外。此時質量較重的同位素比起質量較輕的同位素有著較慢的逸散速率,經過一段時間後,容器內較重的同位素的濃度就會升高,反之在容器外較輕的同位素的濃度也會升高。
這裡舉一個實際的例子,我們可以利用逸散作用來分離鈾235 $$\mathrm{(U^{235})}$$ 以及鈾238 $$\mathrm{(U^{238})}$$。$$\mathrm{U^{235}}$$ 是鈾的三種同位素之一,其中 $$\mathrm{U^{235}}$$ 能夠發生核分裂,引發連鎖核分裂反應,但是在自然界中 $$\mathrm{U^{238}}$$ 的含量約為 $$99.28\%$$,而 $$\mathrm{U^{235}}$$ 的濃度約為 $$0.72\%$$。如果要進行核分裂反應則必須要提高 $$\mathrm{U^{235}}$$ 的比例。
濃縮的步驟如下,首先先將元素鈾轉變成具揮發性的六氟化鈾 $$\mathrm{(UF_6)}$$,$$\mathrm{UF_6}$$ 裡含有分子量分別為 $$349.03~g/mol$$ 的 $$^{235}\mathrm{UF_6}$$ 和分子量為 $$352.04~g/mol$$ 的 $$^{238}\mathrm{UF_6}$$。
由逸散速率和質量的關係得知,$$^{235}\mathrm{UF_6}$$ 和 $$^{238}\mathrm{UF_6}$$ 的逸散速率比為 $$1.0043:1$$,速率比雖然不高,但經過非常多次的逸散過程,我們就可以把 $$^{235}\mathrm{U}$$ 濃縮到可以應用的濃度值,例如核能發電廠的燃料棒(濃度 $$3\%$$~$$5\%$$ 的 $$\mathrm{U}^{235}$$)。
參考文獻
- Carter A。 H。(2001), Classical and statistical thermodynamics, Prentice Hall。
- 維基百科。 Effusion。 http://en。wikipedia。org/wiki/Effusion
- 維基百科。 格銳目定律。
http://zh。wikipedia。org/wiki/%E6%A0%BC%E9%8A%B3%E7%9B%AE%E5%AE%9A%E5%BE%8B - 哈裕銘, 基礎化學(三)講義教學第1章。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] 2016春季展望─天文宇宙大發現](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/03/lec.png) [講座] 2016春季展望─天文宇宙大發現
[講座] 2016春季展望─天文宇宙大發現 ![[影音] 大師講座:楊振寧《美與物理學》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/02/yang_banner_620x280.jpg) [影音] 大師講座:楊振寧《美與物理學》
[影音] 大師講座:楊振寧《美與物理學》  沉睡的怪獸黑洞:臺灣旅美科學家馬中珮發現超大黑洞
沉睡的怪獸黑洞:臺灣旅美科學家馬中珮發現超大黑洞  【丁肇中獲頒諾貝爾物理獎40週年專題】丁院士研究的歷史意義
【丁肇中獲頒諾貝爾物理獎40週年專題】丁院士研究的歷史意義 ![[影音] CASE【百秒說科學】《改變時空形狀的重力波》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/12/Online-620x280.jpg) [影音] CASE【百秒說科學】《改變時空形狀的重力波》
[影音] CASE【百秒說科學】《改變時空形狀的重力波》  大約1961 年1 月:羅倫茲 (Edward Lorenz)和蝴蝶效應
大約1961 年1 月:羅倫茲 (Edward Lorenz)和蝴蝶效應  【2015年諾貝爾物理獎特別報導】宇宙中的變色龍
【2015年諾貝爾物理獎特別報導】宇宙中的變色龍 
