內醯胺
內醯胺 (Lactam)
國立臺灣師範大學化學系黃鈺雅碩士班二年級
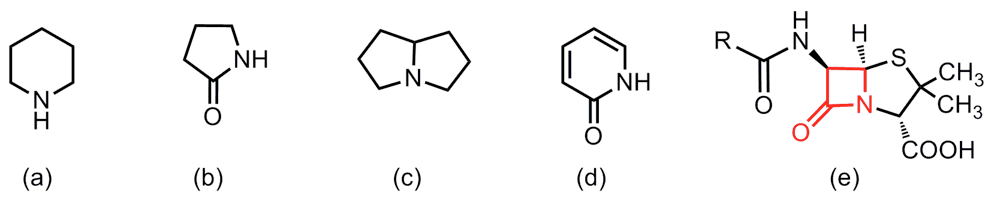
哌啶(piperidine)、內醯胺(lactam)、吡咯里西啶(pyrrolizidine)、吡啶酮(pyridone)為自然界中,常見之含氮雜環天然物,如圖1(a~d)所示。此類含氮骨架之天然物,多具有生物活性或醫藥活性之特質。因此,過去許多化學學者致力於探討合成含氮雜環化合物之相關研究。
其中,於圖1(b)為內醯胺,並與另一環狀架構呈現並環結構,很多天然物含有此骨架,像青黴素 (penicillin) 圖1(e)就是一個典型的例子,而本篇文章將針對內醯胺之架構、合成方式與實際應用進行初步介紹。
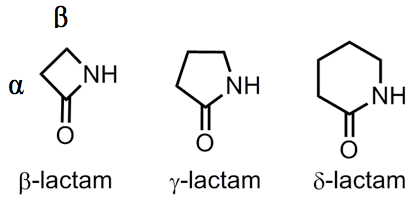
內醯胺(lactam)的命名由來是擷取內酯(lactone)和醯胺(amide)得來,即表示為環狀的醯胺。命名時以內醯胺為主體,由氮 $$\mathrm{(N)}$$ 原子為起始,以希臘字母分別表示為 $$\alpha$$、$$\beta$$、$$\gamma$$,而最小為四員環-$$\beta$$-內醯胺,依次為 $$\gamma$$-內醯胺(五員環)、$$\delta$$-內醯胺(六員環)等,如圖2所示。
本文介紹常見兩種得以在實驗過程中,以合成方式,得到內醯胺之架構的過程:
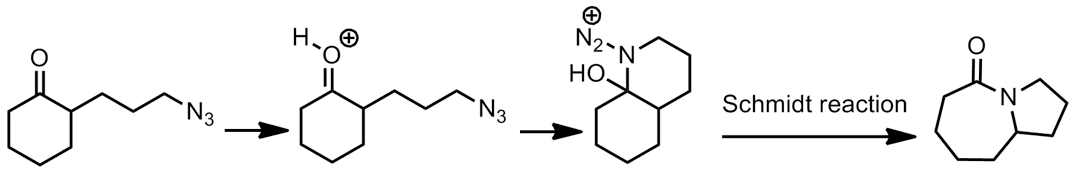
$$(1)$$ 利用帶有酮基之環狀化合物(cyclic ketones)與疊氮酸(hydrazoic acid)進行化學反應,首先酮基與路易士酸配位,疊氮經電子轉移攻打到酮基的碳上,再經由施密特反應(Schmidt reaction)進行重排,以脫去氮氣,便可得到內醯胺(如圖3所示)。[1]
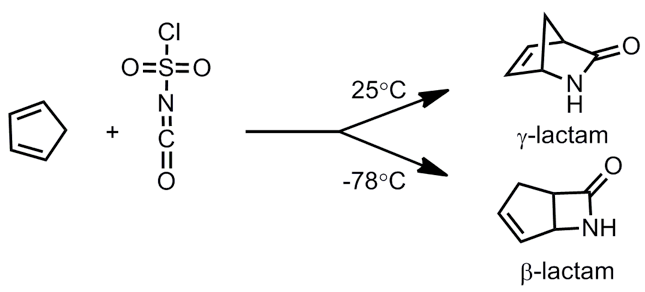
$$(2)$$ 利用環戊二烯(cyclopentadiene)與氯磺醯異氰酸酯(chlorosulfonyl isocyanate)進行狄耳士–阿德爾反應(Diels–Alder reaction):於室溫下,進行[4+2]環化反應,得到 $$\gamma$$-內醯胺;另外,在低溫中 $$(-78^\circ C)$$ 則進行[2+2]環化反應,生成 $$\beta$$-內醯胺(如圖4所示)。[2]
除了上述二種較為人所知之人名反應外,亦可直接利用胺基酸的環化、線形醯基的衍伸物進行分子內環化等等…方式,以合成出內醯胺之骨架。
含氮雜環的化合物大多具有生物活性及藥理性質,現今對於內醯胺之應用,經常作為藥理之抗生素,例如:$$\beta$$-內醯胺類抗生素中,存在 $$\beta$$-內醯胺之主架構。而 $$\beta$$-內醯胺類抗生素之種類相當廣泛,如頭孢菌素、碳青微烯、青霉素及其衍生物等。
其中,較為廣為人知的 $$\beta$$-內醯胺類抗生素為青黴素 (penicillins),亦稱為盤尼西林(如圖1(e)),此為人類史上第一個發現之抗生素,因此類抗生素係經由青霉菌提煉而來,故得其名。[3] 而 $$\beta$$-內醯胺胺類抗生素可作為人體抗生素之主因為:$$\beta$$-內醯胺類抗生素主要針對人體中細菌之細胞壁進行反應,然而人體細胞中,並無細胞壁存在,故對人類的毒性較小,而這類抗生素常用以治療和預防被同類抗生素打擊的細菌。
在藥品之副作用方面,雖 $$\beta$$-內醯胺類抗生素相較於其他藥物之副作用程度較少且較為安全,然而,於過去之病史資料中,亦曾發生過致命性之不良反應,如過敏性休克,使用時仍須考量其對人體之副作用程度。[4]
參考資料
- [1] 施密特反應(Schmidtreaction)合成內醯胺
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2596723/pdf/nihms63731.pdf - [2] 狄耳士–阿德爾反應(Diels–Alder reaction)合成內醯胺
http://en.wikipedia.org/wiki/Lactam#cite_note-2 - [3] β-內醯胺類抗生素簡介
http://en.wikipedia.org/wiki/%CE%92-Lactam_antibiotic - [4] β-內醯胺類抗生素及其抗藥性
http://www.tsim.org.tw/journal/jour10-5/P10_185.pdf


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  化學的填字遊戲?
化學的填字遊戲? ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應 
