釤(Samarium)
釤(Samarium)
臺北市立永春高級中學一年級陳忠霖/臺北市立永春高級中學化學科蔡曉信老師
簡介:
釤是元素週期表中鑭系元素,原子序為 $$62$$,元素符號為 $$\mathrm{Sm}$$。中等硬度的銀白色金屬,在空氣中容易氧化。釤最常見的氧化數為 $$+3$$,但釤的二價化合物如氧化釤 $$\mathrm{(SmO)}$$、硫化釤 $$\mathrm{(SmS)}$$、硒化釤 $$\mathrm{(SmSe)}$$、碲化釤 $$\mathrm{(SmTe)}$$ 與二碘化釤 $$\mathrm{(SmI_2)}$$ 等亦很常見 ,其中二碘化釤在化學合成上是一種常見的還原劑。釤雖然歸類為稀土元素,但在地殼中是含量排名 $$40$$ 的元素比錫等金屬更常見。釤沒有顯著的生物學反應性,但具有些微毒性。
發現:
釤是 1879 年由法國化學家博亞波德蘭(Boisbaudran)發現的。早在 1803 年鈰元素發現時,科學家就推測裡面可能還含有好幾種元素,直到 1879 年才從此類含鈰的混合物中分離出鑭與 didymium(鐠 $$\{\mathrm{Pr},59\}$$ 與釹 $$\{\mathrm{Nd},60\}$$ 之通稱)。因此博亞波德蘭才在同年證明 didymium 是一種混合物。他從鈮釔礦(Samarskite)中將這種新元素分離出來,而將此新元素命名為釤。
用途:
釤的工業用途一般都被用來作成釤鈷磁鐵,它的磁力與普通的磁鐵將較強度超過一萬倍,在釹磁石被研發出來之前,它是最強的永久性磁鐵。它大部份應用在馬達及頭戴式耳機上。由於它可以耐超過 $$700$$ 度的高溫且不會失去磁性,所以至今仍大量用在微波設備上。此外,氧化釤可以吸收紅外線,因此也被運用在陶瓷和玻璃的製造。氟化鈣添加釤,可當作雷射及微波激射器的材料,連鋼鐵都能切斷。
同位素:
釤-153放射性的同位素可用來製造抗癌藥物,其重要組成成分為釤-153 lexidronam(Quadramet);另一種同位素釤-149,是強的中子吸收劑,可應用於核子反應爐的控制棒。釤的其他應用包括化學反應的催化作用,利用其放射性進行年代測定與製造X射線雷射等。
物理性質:
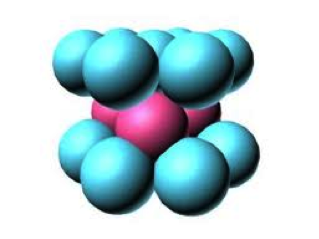
釤為稀土類金屬但其硬度和密度與鋅類似。沸點為 $$1794^\circ C$$,釤在鑭系元素中之揮發性僅次於鐿和銪元素,因此從礦石中分離出釤元素便是利用其較高的揮發性。在常溫常壓下,釤通常是三方晶系結構(trigonal structure) ,當加熱至 $$731^\circ C$$,其結構轉變成六方緊密堆積(hexagonal close-packed)(圖一)
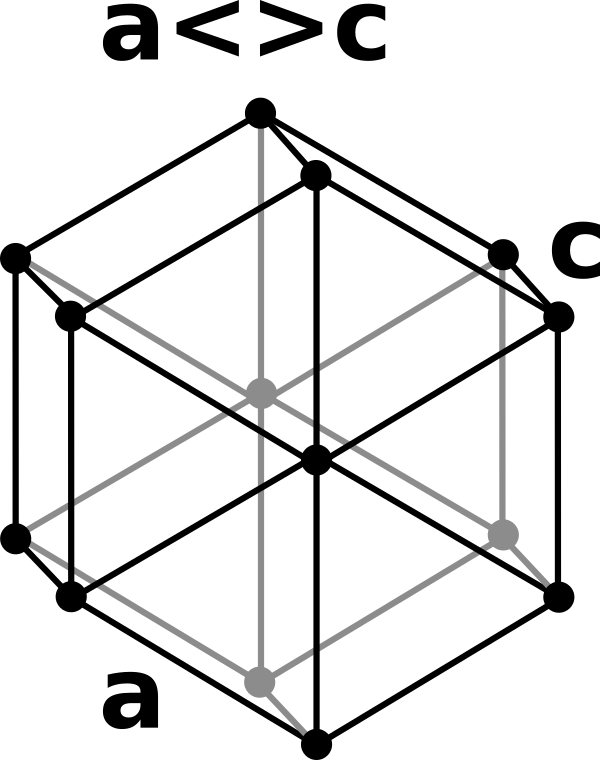
,進一步加熱到 $$922^\circ C$$ 下金屬結構變成的體心立方( body-centered cubic)。若加熱到 $$300^\circ C$$ 並將壓力提升至 $$40$$ 千帕會形成一個雙六方緊密堆積結構(double-hexagonal close-packed structure )(圖二)。
化學性質:
剛製備而得的釤有銀白色的光澤,但在空氣中,它會慢慢地氧化,在 $$150^\circ C$$ 時即具有自燃性,即使儲存於礦物油中,釤也會漸漸氧化,並在表面形成灰黃色粉末狀的氫氧化物混合物。因此必需保存在密封的惰性氣體容器中。
釤是正電性金屬,可與冷水緩慢反應或熱水迅速的反應形成氫氧化釤:
$$\mathrm{2Sm_{(s)}+6H_2O_{(l)}\rightarrow 2Sm(OH)_{3(aq)}+3H_{2(g)}}$$
釤易溶於稀硫酸形成黃色至淺綠色的 $$\mathrm{Sm(III)}$$ 離子,它以 $$\mathrm{[Sm(OH_2)_9]^{3+}}$$ 錯合物的形式存在:
$$\mathrm{2Sm_{(s)}+3H_2SO_{4(aq)}\rightarrow 2Sm_{(aq)}^{3+}+SO_{4(aq)}^{2-}+3H_{2(g)}}$$
製備:
其製備方法如下:
- 雖然許多稀土礦中均含有釤元素,但釤幾乎全是由獨居石中提取而得的。
- 放射性物質衰變的產物中也有釤,工業上也利用離子交換法分離和純化釤。
- 用金屬鑭熱還原釤的氧化物 $$\mathrm{Sm_2O_3}$$ 然後將金屬釤蒸出也可得到金屬釤。
- 將熔融態之氯化釤 $$\mathrm{SmCl_3}$$ 電解也可獲得。
化合物:
釤的氧化物中最穩定者為三氧化二釤 $$(\mathrm{Sm_2O_3})$$。它亦與其他許多的釤化物相同,存有幾種結晶相。而三方晶系結構是從熔體緩慢冷卻而得。$$\mathrm{Sm_2O_3}$$ 的熔點相當高 $$(2345^\circ C)$$,因此通常不以直接加熱達到此高溫,而是使用通過一個射頻線圈的感應加熱法(Induction heating)。
$$\mathrm{Sm_2O_3}$$ 的粉末可經由火焰熔融法(flame fusion method)產生 $$\mathrm{Sm_2O_3}$$ 結晶的單斜晶系(monoclinic)之對稱晶體,晶體為筒狀的晶柱長約數厘米,直徑大約一厘米。純淨的晶柱呈透明狀,若含雜質則為橙色。加熱三方晶系結構的 $$\mathrm{Sm_2O_3}$$ 至 $$1900^\circ C$$,可將它轉換到更穩定的單斜晶相。
釤是少數可以形成一氧化釤 $$(\mathrm{SmO})$$ 的鑭系元素。在 $$1000^\circ C$$ 溫度和高於 $$50$$ 千帕的壓力下,$$\mathrm{Sm_2O_3}$$ 的減少能得到有光澤的金黃色的化合物。$$\mathrm{SmO}$$ 為立方岩鹽晶格結構。
參考資料:
- Samarium。檢索日期 2014.8.2, http://en.wikipedia.org/wiki/Samarium
- STUDIO HARD Deluxe。超萌!化學元素週期表。如何出版社,P.132~133。
- 西奧多、葛雷,譯者吳瑤玲(2010) 。看得到的化學,你一輩都會用到的化學知識。台北市:大是文化有限公司。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第? ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  化學的填字遊戲?
化學的填字遊戲? 
