定壓熱容量(Cp)和定容熱容量(Cv)的差別(下)
定壓熱容量(Cp)和定容熱容量(Cv)的差別(下)
國立臺灣師範大學化學系兼任教師邱智宏
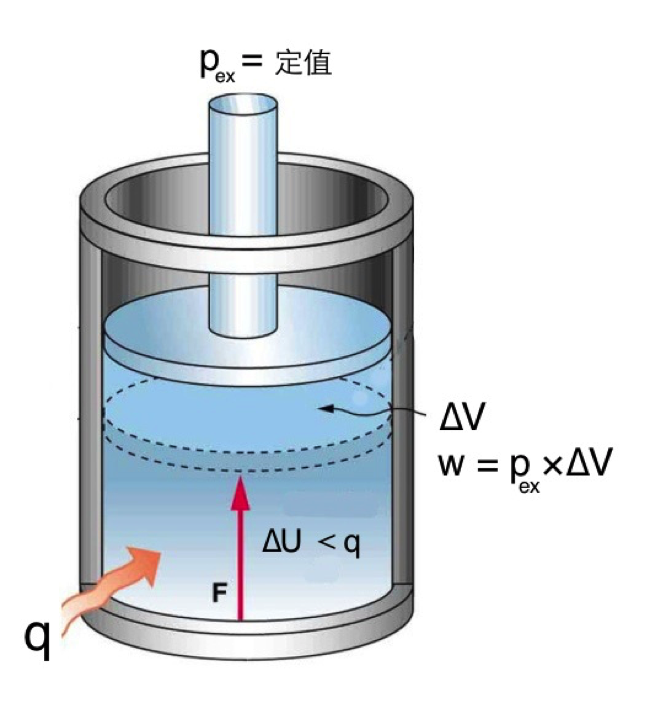
有了上篇 \(C_V\) 的測量基礎,為了更易於了解,我們先以氣體為例,若測定一定量氣體的 \(C_V\),其升高 \(1~K\) 所需的內能變化\((\Delta U)\),由於没有對外作功,其情況顯然和定壓下升高 \(1~K\),焓的變化量\((\Delta H)\)有所不同,如圖二所示:當系統在等壓情況下,吸收定量的熱時,除了系統的內能會增加,系統內的溫度因而上升,使容器內壓力加大向上膨脹,對外作功,直至內壓等於外壓\((p_{ex})\)時停止。此時系統對外做功\((w=p_{ex}\times \Delta V)\),因此系統吸收的總熱量\((q)\),有一部分要用來對外作功,所以系統增加的內能\((\Delta U)\)將小於 \(q\)。
據此,等量的物質,在定壓下系統上升 \(1~K\),所吸收的熱量\((q_p)\),要比在定容下上升 \(1~K\) 所需的熱量\((q_c)\)還要多,因此在氣態的物質中,\(C_p\) 恒大於 \(C_V\)。
三、\(C_p\) 和 \(C_V\) 相差多少
若直接將 \(C_p\) 和 \(C_V\) 相減,\(C_p-C_V=(\frac{\partial H}{\partial T})_p-(\frac{\partial U}{\partial T})_V\),並將 \(H=U+pV\) 代入
\(C_p-C_V=(\frac{\partial U}{\partial T})_p+(\frac{\partial (pV)}{\partial T})_p-(\frac{\partial U}{\partial T})_V~~~~~~~~~(8)\)
上式中,「定壓下」內能隨溫度的變化率,減定容下內能隨溫度的變化率:\((\frac{\partial U}{\partial T})_p-(\frac{\partial U}{\partial T})_V\),代表什麼意義?
若由 \((2)\) 式開始推導,並在定壓下,以溫度對 \((2)\) 式微分可得 \((9)\) 式
\(\mathrm{d}U=C_V\mathrm{d}T+\pi_T\mathrm{d}V~~~~~~~~~(2)\)
\((\frac{\partial U}{\partial T})_p=C_V+\pi_T(\frac{\partial V}{\partial T})_p~~~~~~~~~(9)\)
其中 \((\frac{\partial U}{\partial T})_p\),代表在定壓下,溫度改變對體積的影響,
一般以膨脹係數\((\alpha)\)表示,\(\alpha=\frac{1}{V}(\frac{\partial V}{\partial T})_p\),
另外 \(C_V=(\frac{\partial U}{\partial T})_V\),將此二者代入 \((9)\) 式,並適當移項
\((\frac{\partial U}{\partial T})_p-(\frac{\partial U}{\partial T})_V=\pi_T\alpha V\)
將結果代入 \((8)\) 式:\(C_p-C_V=\pi_T\alpha V+(\frac{\partial (pV)}{\partial T})_p\),
其中最後一項,因 \(p\) 為定值,\((\frac{\partial (pV)}{\partial T})_p=p(\frac{\partial V}{\partial T})_p=p\alpha V\)
\(C_p-C_V=\pi_T\alpha V+p\alpha V~~~~~~~~~(10)\)
上式中 \(\alpha V\) 為系統於溫度改變時體積的變化率,\(p\alpha V\) 則為溫度改變時系統作功的量,
因此影響 \(C_p\) 和 \(C_V\) 差別的第一個因素,即為 \(C_p\) 需對外作功,而 \(C_V\) 為定容則否。
第二個因素為 \(\pi_T\alpha V\) 則較為複雜,
\(\pi_T=(\frac{\partial U}{\partial V})_T\) 為系統在定溫下,改變體積對系統內能的影響,
例如氣體分子間彼此有吸引力,如果增大體積時則須提供能量,以迫使分子分開。
以下探討三種不同的情況:
- 如果是理想氣體的情況,分子間並不存在任何引力,因此 \(\pi_T=0\),即增大體積對系統的內能没有影響。據此 \((10)\) 式可改寫如下(由於 \(pV=nRT\),\((\frac{\partial V}{\partial T})_p=\frac{1}{p}(\frac{\partial (nRT)}{\partial T})_p=\frac{nR}{p}\))
\(C_p-C_V=p\alpha V=p(\frac{\partial V}{\partial T})_p=p\frac{nR}{p}=nR~~~~~~~~~(11)\) - 如果不是理想氣體時,\(\pi_T\ne 0\),\(C_p\) 和 \(C_V\) 的差異就必須按照 \((10)\) 式來計算,\((11)\) 式僅為理想氣體的特殊情況,式 \((10)\) 才是通式。
- 如果是固體或液體的情形,由於溫度的改變對於體積的改變不大,其 \(\alpha V\) 值很小,因此一般情況 \((10)\) 中的 \(C_p-C_V\approx 0\),亦即兩者幾乎相等。
四、\(C_p/C_V=\gamma\) 的使用時機
\(\gamma\) 值通常在絕熱情況下,探討理想氣體在不同狀態,其 \(p\)、\(V\)、\(T\) 間的關係時才會使用到。
一般理想氣體若在等溫時,\(pV=\)定值,但若在絕熱、可逆的情況下則情況就不同,
假設體積由 \(V_i\) 改變為 \(V_f\),則 \(V\) 與 \(p\) 和 \(T\) 間的變化有何關係式。
因為 \(\mathrm{d}U=\mathrm{d}q+\mathrm{d}w\),在絕熱狀況下,因為 \(\mathrm{d}q=0\),所以 \(\mathrm{d}U =\mathrm{d}w = -p\mathrm{d}V\),
另外 \(\mathrm{d}U = C_V\mathrm{d}T\),因此 \(C_V\mathrm{d}T=-p\mathrm{d}V\) ,
將 \(p = nRT/V\) 代入前式,共並移項整理可得:
\(C_V\frac{\mathrm{d}T}{T}=-nR\frac{\mathrm{d}V}{V}\)
兩邊積分:\(\int_{T_i}^{T_f}C_V\frac{\mathrm{d}T}{T}=\int_{V_i}^{V_f}-nR\frac{\mathrm{d}V}{V}\Rightarrow C_V\ln\frac{T_f}{T_i}=-nR\ln\frac{V_f}{V_i}\)
\((\frac{T_f}{T_i})^{C_V}=(\frac{V_i}{V_f})^{nR}~~~~~~~~~(12)\)
若將 \(T_i\) 和 \(T_f\) 藉 \(pV=nRT\),換成 \(p_i\)、\(V_i\) 和 \(p_f\)、\(V_f\),則式 \((12)\) 可化簡如下:
\((\frac{p_f}{p_i}\frac{V_f}{V_i})^{C_V}=(\frac{V_i}{V_f})^{nR}\Rightarrow (\frac{p_f}{p_i}\frac{V_f}{V_i})=(\frac{V_i}{V_f})^{\frac{nR}{C_V}}\Rightarrow (\frac{p_f}{p_i})=(\frac{V_i}{V_f})^{\frac{nR}{C_V}+1}\)
由式 \((12)\) 可知 \(C_V+nR=C_p\),因此上式的 \((nR/C_V)+1=C_p/C_V\),
若將 \(C_p/C_V=\gamma\),則上式可表示如下:
\(p_fV_f^\gamma=p_iV_i^\gamma=\)定值\(~~~~~~~~~(13)\)
五、總結
由上列的推導可知,\(C_p\) 和 \(C_V\) 差異如式 \((10)\) 所列,\(C_p\) 除了必須對外作功以外 \((p\alpha V)\),尚須克服分子間的引力 \((\pi_T\alpha V)\),因此 \(C_p\) 在一般情況大於 \(C_V\)。式 \((10)\) 為通式,對於任何物質均適用,若使用在特殊情況下,例如理想氣體,由於分子間無引力存在,因此 \(C_p\) 和 \(C_V\) 間的差異,就如式 \((11)\) 所示,相差 \(nR\),如果是真實氣體,式 \((11)\) 便不適用,必須再經由式 \((10)\) 推導。
另外,在固體或液體的情形,由於溫度的改變對於體積的改變不大,其 \(\alpha\) 值很小,例如水為 \(2.1\times 10^{-4}K^{-1}\)、鑽石為 \(3.0\times 10^{-6}K^{-1}\),因此 \(C_p-C_V\approx 0\),亦即兩者幾乎相等。
最後,對於一般甫上化學熱力學的學子而言,常將 \(pV=constant\),誤視為通式,殊不知理想氣體在絕熱、可逆的條件下,則必須 \(pV^\gamma=constant\),方能成立,當然這也是一種特例,而不是通式。
參考資料
- http://physiclessons.blogspot.tw/2012/11/blog-post_26.html
- P. W. Atkins, “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p. 99~114 (1994).


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會  強化玻璃
強化玻璃  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》 
