凡得瓦方程式
凡得瓦方程式(Van der Waals equation)
國立臺灣大學化學系 101級 葉德緯
相信大家都對理想氣體方程式(ideal gas equation)再熟悉不過了,不論是高中物理或是化學課程都看得到它的蹤影:
\(PV = nRT\)
\(R\) 為理想氣體常數,\(R=8.3145~J/K\cdot mol\)。不過實際上,理想氣體方程式在使用上有不少的限制,例如其忽略了氣體分子間的作用力以及分子的大小等等,使得一般氣體必須在低壓高溫時才能比較接近理想氣體。在一般情況下比較符合理想氣體表現的典型有分子量很小的氫氣或氦氣,但是不少氣體的表現則偏離了理想氣體方程式的預測。
首位提出簡單修正而又相當符合物理直觀模型的,正是由凡得瓦(Johannes Diderik van der Waals)。他於1873年提出的模型方程式(後世稱為凡得瓦方程式)如下:
\(\displaystyle(P+\frac{a}{\overline{V}^2})(\overline{V}-b)=RT\)
其中 \(\overline{V}\) 代表每莫耳分子的體積(molar volume),\(\overline{V}=V/n\)。同時這個方程式裡面多出了兩個比較不熟悉的參數 \(a\) 和 \(b\),是凡得瓦對於理想氣體方程式所作的主要修正。\(a/\overline{V}^2\) 這項是加入了分子間吸引力的影響,很直觀地,當每個分子所能分配到的體積越大時,分子間作用力的影響越小,也就導致 \(a/\overline{V}^2\) 會越小。
而 \(b\) 主要是考慮到每個分子真實的體積對於氣體狀態的影響,例如每個分子真正可以自由移動的體積必須把自己的體積扣掉,也就是 \(\overline{V}-b\)。\(a\) 和 \(b\) 都隨著氣體種類而異,稱為凡得瓦常數(van der Waals Constant),藉由實驗可以得到,表一是部分常見氣體的凡得瓦常數。可以發現,一般來說被認為較接近理想氣體的氣體分子,其凡得瓦常數都會比較小。
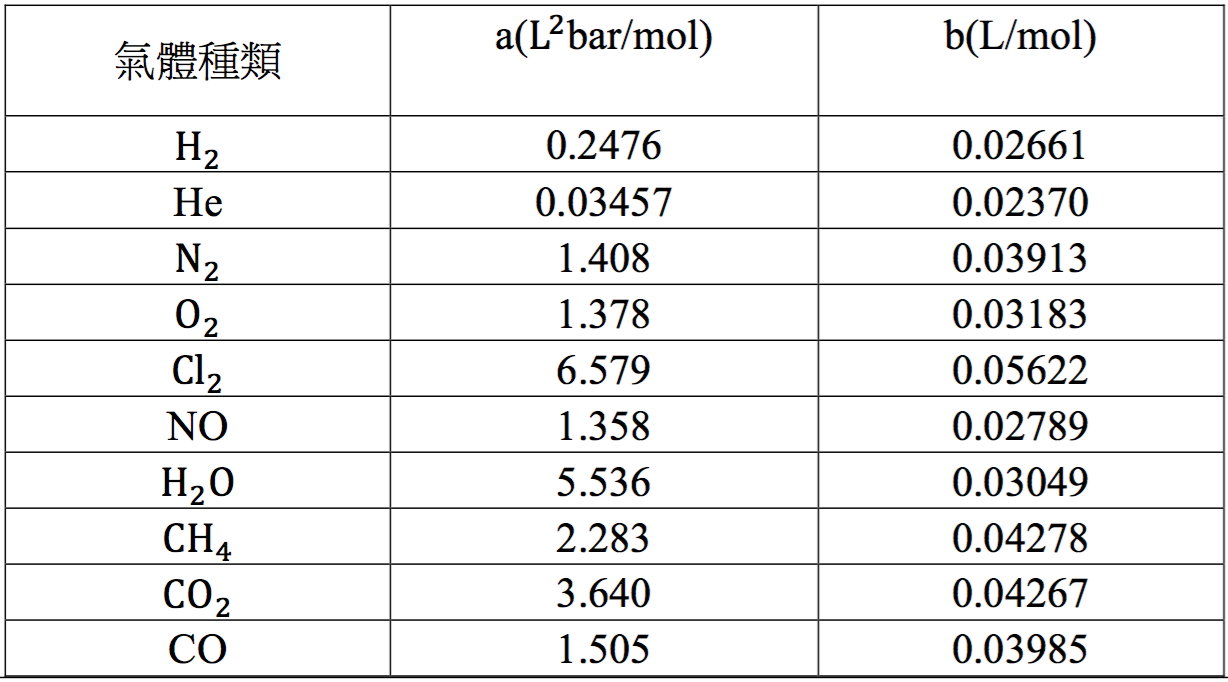
表一\(~~~\)常見氣體的凡得瓦常數 (出處:Silbey, R. J. & Alberty R. A. & Bawendi M. G. (2004). Physical Chemistry, 4th edition. Hoboken, John Wiley and Sons.; table 1.13)
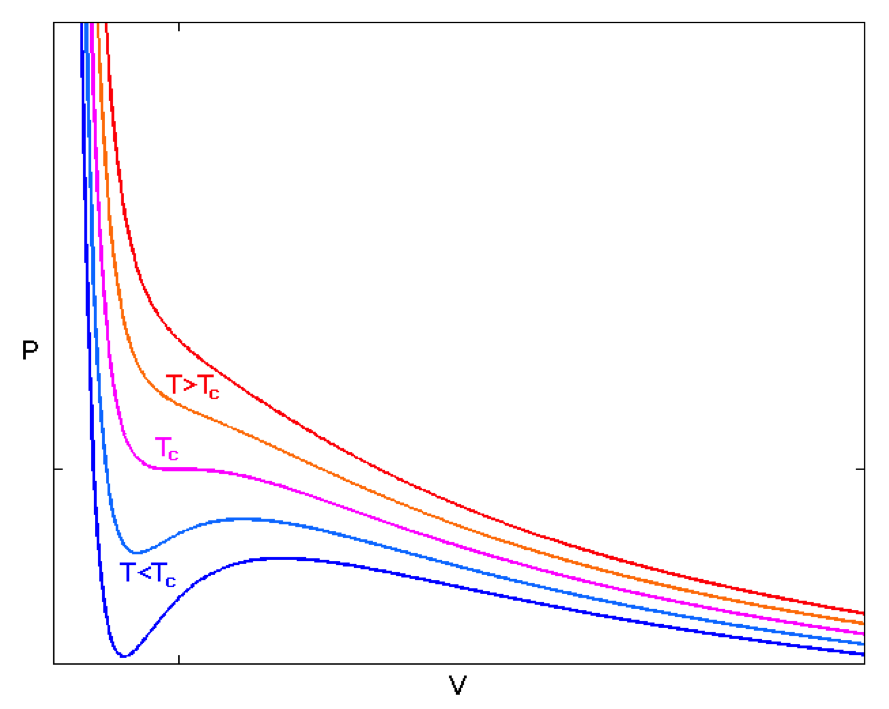
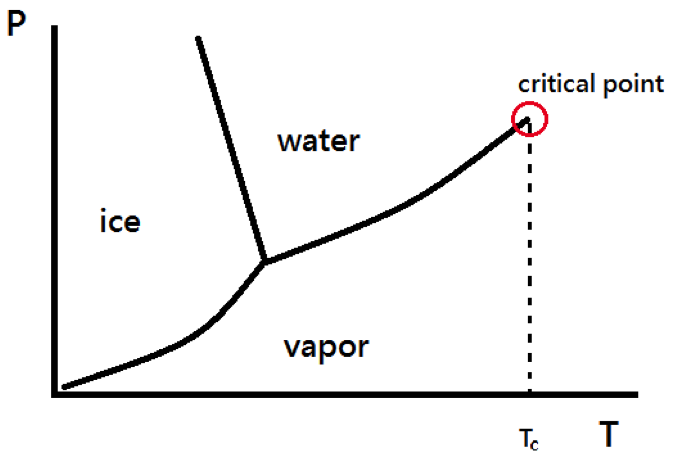
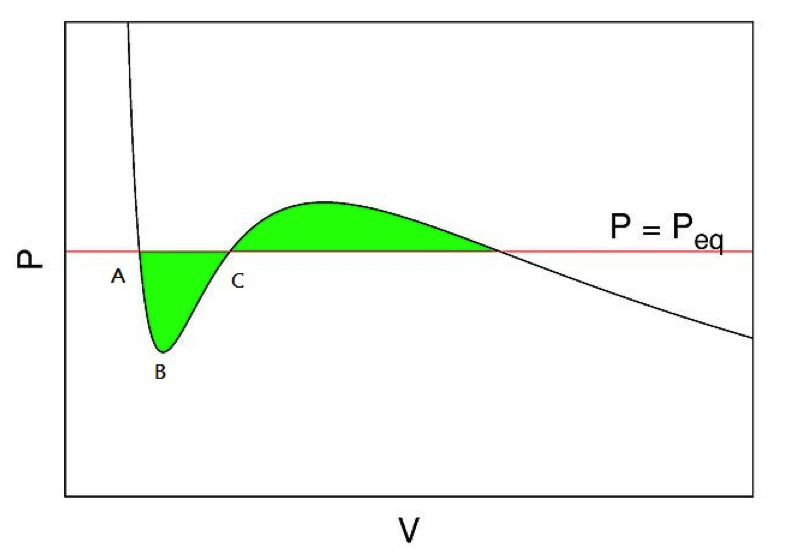
凡得瓦方程式的圖形如圖一所示,可以看到,因為多加入了兩個參數,所以呈現出來的圖形並不是單純的反比圖形,中間會有一點凹下的趨勢。圖中可以看到,溫度越低,凹下的趨勢越明顯,當溫度小於一定值 \(T_c\) 時,甚至會有隨著壓力增加而體積也跟著增加的部分出現(圖三 \(A\rightarrow B\rightarrow C\) 區段),這和我們的物理常識是互相違背的,這也是凡得瓦方程式的缺失之一。我們通常把 \(T_c\) 這個溫度視為與真實流體在相圖中液氣共存曲線(圖二)上的臨界溫度(critical temperature)相對應。臨界溫度的凡得瓦方程式圖形會有斜率為 \(0\) 的點,該點即對應到液氣共存曲線上的臨界點(critical point)。
從相圖中可以看出,溫度在臨界點以上時,液體和氣體是沒有分隔的流體,此時兩者的物理性質會相同而無法分辨。而我們一般熟悉的狀態是在臨界點以下,有液體和氣體的分別,也就是凡得瓦方程式的圖形中有違背物理常識的那區。
其實,凡得瓦的洞視就在於他體認到,凡得瓦方程式描述的不只是氣體,而是代表氣體和液體的「流體(fluid)」,而那塊不符合物理常識的區間,可能可以代表液相與氣相的轉變。這想法之後由馬克世威(James Clerk Maxwell)在1875年提出的馬克士威建構法(Maxwell construction)得到進一步的討論與體現。基於一些更進階的熱力學原理,馬克士威可以論證出來,當我們用一條水平線使得圖三中兩塊綠色面積相等時,該水平線和定壓下氣體轉變成液體時體積的增加相符合。而凡得瓦方程式也可以用於臨界溫度的預測,藉由簡單的微積分計算,可以得到以下的式子:
\(T_c=\displaystyle\frac{8a}{27Rb}\)
參考文獻
- Silbey, R. J. & Alberty R. A. & Bawendi M. G. (2004). Physical Chemistry, 4th edition(pp. 8, 15-21). Hoboken, John Wiley and Sons.
- 維基百科. Van der Waals equation. http://en.wikipedia.org/wiki/Van_der_Waals_equation
- 維基百科. Maxwell construction. http://en.wikipedia.org/wiki/Maxwell_construction


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[影音] 大師講座:楊振寧《美與物理學》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/02/yang_banner_620x280.jpg) [影音] 大師講座:楊振寧《美與物理學》
[影音] 大師講座:楊振寧《美與物理學》 ![[影音] CASE電影講座:星際效應,有影無?](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2014/12/2014-12-19-午12.41.44-592x350.png) [影音] CASE電影講座:星際效應,有影無?
[影音] CASE電影講座:星際效應,有影無?  【丁肇中獲頒諾貝爾物理獎40週年專題】丁肇中院士介紹
【丁肇中獲頒諾貝爾物理獎40週年專題】丁肇中院士介紹 ![[講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/110600223.png) [講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險
[講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險  【2014諾貝爾物理獎】照亮世界的嶄新光芒
【2014諾貝爾物理獎】照亮世界的嶄新光芒 ![[課程] VPhysics Python 於物理上之應用](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/07/V物理.png) [課程] VPhysics Python 於物理上之應用
[課程] VPhysics Python 於物理上之應用 ![[影音] CASE【百秒說科學】《改變時空形狀的重力波》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/12/Online-620x280.jpg) [影音] CASE【百秒說科學】《改變時空形狀的重力波》
[影音] CASE【百秒說科學】《改變時空形狀的重力波》  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破 
