霍納-沃茲沃思-埃蒙斯烯烴合成反應
霍納-沃茲沃思-埃蒙斯烯烴合成反應 (Horner-Wadsworth-Emmons Olefination)
國立臺灣師範大學化學系博士生 林欣慧
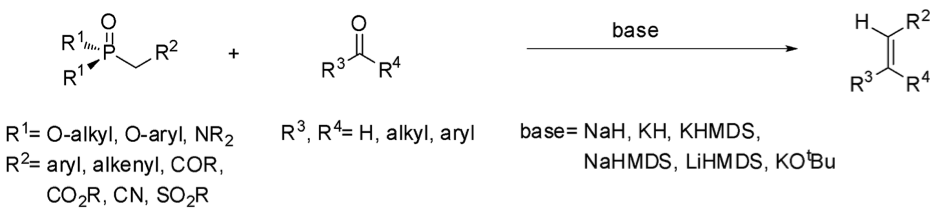
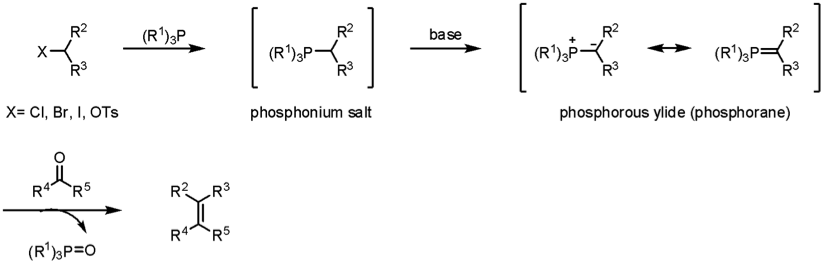
由天然物所發現的藥物分子結構中有許多的官能基,碳 – 碳雙鍵即是其中常見的一種。因此,對於如何合成碳 – 碳雙鍵就成為了科學家所注重的問題。在現今的化學界中已有許多成熟的碳-碳雙鍵合成方法,諸如:威悌反應 (Wittig reaction)、霍夫曼消去反應 (Hoffmann elimination) 等多種反應,以及今天要介紹的霍納-沃茲沃思-埃蒙斯烯烴合成反應 (Horner-Wadsworth-Emmons olefination, HWE olefination)(圖一)1,2。
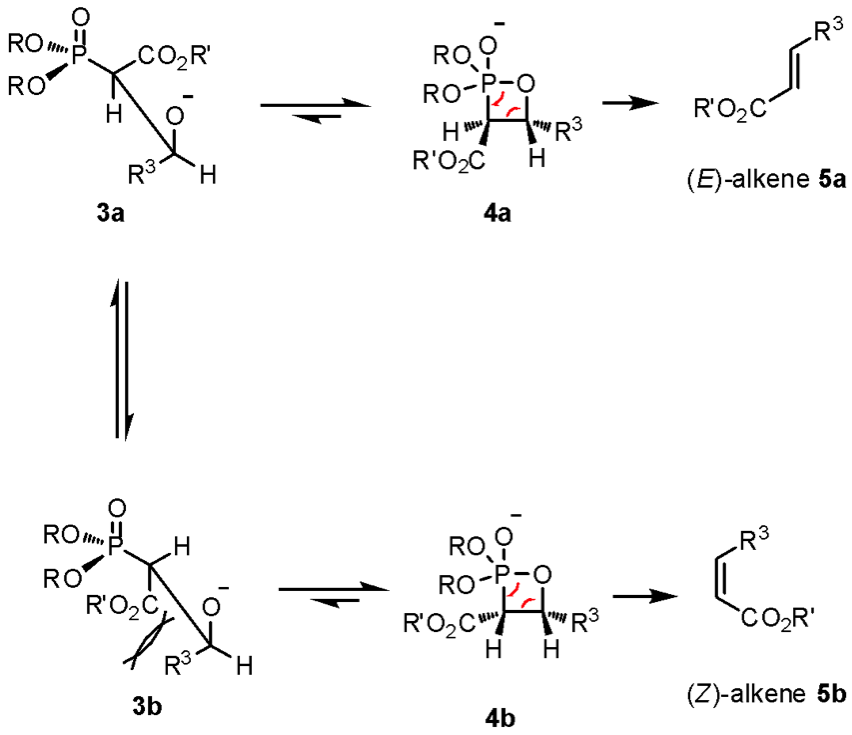
HWE烯烴化反應是由Leopold Horner教授於1958年首先發表,而後在1965年由William S. Wadsworth、William D. Emmons兩位教授再進行研究完善的成果。利用膦酸酯 (phosphonate) 在鹼的幫助下,將醛類或酮類的羰基置換成烯基,其反應機制為:首先鹼先抓掉磷酸酯分子 1 位於 α- 位置的氫形成中間體 1a 並攻擊醛分子 2,此時會因中間體 1a 進行攻擊時的位向不同而形成 3a 與 3b 兩種不同的中間體,且中間體 3a、3b 間可互相平衡(圖二)。
接著中間體 3a 及 3b 會進行分子內 [2+2] 環化反應,分別形成四圓環中間體 4a 與 4b;由於氧 – 磷雙鍵的鍵能較強的緣故,故兩者會再進行逆 [2+2] 環化反應並脫去帶有氧-磷雙鍵的副產物形成反式構型的烯類產物 5a 以及順式構型的烯類產物 5b。因為中間體 3b 分子內具有立體障礙且 3a、3b 可互相平衡,所以反應最終多是以生成反式構型的烯類產物 5a 為主(圖三)。
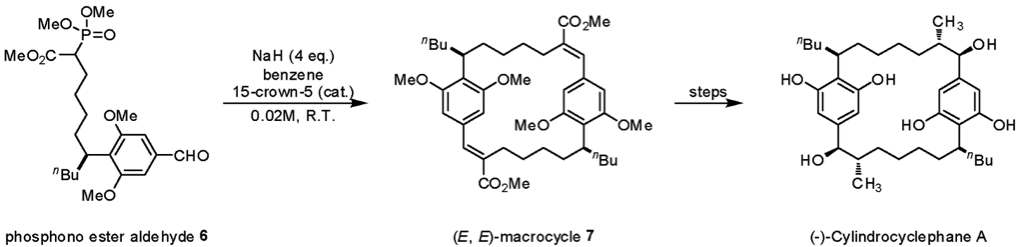
HWE 反應在天然物的合成上也有許多應用的例子:如 Hoye 教授在合成天然物 (-)-Cylindrocyclophane A 時3,利用兩當量具有膦酸酯以及醛官能基的化合物 6 進行 HWE 烯烴化反應形成一個巨環分子 7,接著再進行後續的步驟以合成目標產物(圖四)。值得注意的是 Hoye 教授在進行 HWE 烯烴化反應時僅得到反式的雙鍵,表示此反應的選擇性極佳。
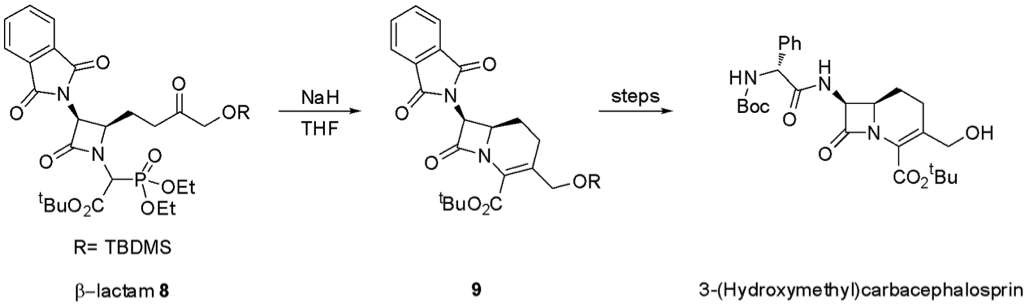
Miller 教授先利用光延反應得到關鍵的中間體 β- 內醯胺 8,接著在鹼性的條件下此分子會進行分子內的 HWE 烯烴化反應得到雙環分子 9,最後再進行後續的合成步驟後得到最終產物 3-(Hydroxymethyl) carbacephalosprin4。由上述兩個簡單的例子我們可以知道 HWE 烯烴化反應在全合成反應中的實用性非常廣。另外,此反應也很容易與威悌反應混淆(圖六)5。
雖然兩者同樣都是利用有機磷試劑作為合成碳-碳雙鍵的反應試劑,但 HWE 烯烴化反應與威悌反應相比之下優勢如下:(1)作為起始物的有機磷試劑在製備上較鏻鹽 (phosphonium salt) 簡單以及便宜;(2)膦酸酯的親核性較磷偶極體 (phosphorous ylide) 強,所以反應條件較為溫和;(3)對於參與反應醛、酮試劑具有較廣的適用性;(4)與威悌反應不同,HWE 烯烴化的副產物膦酸酯為水溶性,有助於與烯類產物分離;(5)具有較佳的反式產物選擇性,而威悌反應則是順式的產物居多。因此 HWE 烯烴化反應雖然問世的時間不長,但以上幾個優點也讓 HWE 烯烴化反應迅速地成為在藥物合成領域中的新寵兒。
參考文獻
- Kürti, L. & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis: Background and detailed mechanisms. pp. 212-213. Amsterdam: Elsevier Academic Press.
- Horner–Wadsworth–Emmons reaction — Wikipedia. http://en.wikipedia.org/wiki/Horner–Wadsworth–Emmons_reaction
- Hoye, T. R., Humpal, P. E., & Moon, B. (2000). Total synthesis of (-)-cylindrocyclophane A via a double Horner-Emmons macrocyclic dimerization event. Journal of the American Chemical Society, 122(20), 4982-4983.
- Stocksdale, M. G., Ramurthy, S., & Miller, M. J. (1998). Asymmetric Total Synthesis of an Important 3-(Hydroxymethyl) carbacephalosporin. The Journal of Organic Chemistry, 63(4), 1221-1225.
- Kürti, L., & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis: Background and detailed mechanisms. pp. 486-487. Amsterdam: Elsevier Academic Press.



 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係
化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  化學的填字遊戲?
化學的填字遊戲?  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體 
