理想氣體和凡得瓦爾氣體的比較-以二氧化碳為例
理想氣體和凡得瓦爾氣體的比較-以二氧化碳為例
(Comparison of ideal gas and van der Waals gases – a case study in carbon dioxide)
國立臺灣師範大學化學系兼任教師 邱智宏
初學物理化學 (physical chemistry) 時,理想氣體 (perfect gas) 如影隨形,無時不在,隨時出現在各個不同的章節。由於理想氣體假設其氣體粒子不具有體積、粒子間没有吸引力、彼此間的碰撞為彈性碰撞,因此其 \(p \cdot V \cdot T\) 間的關係,可以簡潔的以 \(pV=nRT\) 加以描述。
然而真實氣體究竟佔有體積,彼此具有吸引力,碰撞時也非彈性碰撞,因此其許多特性和理想氣體不一樣,例如低溫高壓下,真實氣體大大偏離理想氣體、能被液化、有特殊的臨界點 (critical point)⋯ 等。歷來許多科學家總希望由簡潔的理想氣體方程式出發,企圖能找到一個足以說明真實氣體的方程式,其中凡得瓦爾方程式 (van der Waals equation) 就是一個很好的例子,在數學上雖然稍微複雜一些,但卻能解釋很多真實氣體的現象。
本文試著比較二種方程式的異同,並由其相異之處,解釋為何凡得瓦爾方程式更能接近真實氣體的理由。另外,以二氧化碳為例,觀察其相圖的變化情形,並說明凡得瓦爾方程式可信及不足之處。
一、凡得瓦爾方程式
1873年凡得瓦爾 (Johannes van der Waals) 提出凡得瓦爾方程式如下:
\(\displaystyle p=\frac{nRT}{V-nb}-a(\frac{n}{V})^2\)
他認為理氣體方程式需做二項修正,其一為氣體粒子本身確實擁有體積(以 \(nb\) 表示),因此粒子可運行的空間縮小,變成 \(V-nb\),由於粒子所處的體積變小,排斥力增加,此項因素使得系統的壓力變大。其二為粒子間具有引力,使得粒子碰撞器壁的力量減小、碰撞的頻率也降低,此兩者均與單位體積的分子數有關(\(n/V\))有關,因此系統實際感受到的壓力應減去 \(a(n/V)^2\)。其中 \(a\)、\(b\) 稱為凡得瓦爾係數,因不同的氣體而異。若將上式 \(V\) 除以 \(n\),可得莫耳體積\((V_m)\),因此上式可改寫如下。
\(\displaystyle p=\frac{RT}{V_m-b}-\frac{a}{V_m^2}~~~~~~~~~(1)\)
由 \((1)\) 式可知,當高溫及莫耳體積很大時,因為 \(RT\) 值很大,此時 \((1)\) 式右邊的第二項可忽略,另外\(V_m\) 很大時,\(V_m-b\approx V_m\),此時 \((1)\) 式便還原成理想氣體方程式 \((pV = nRT)\)。
二、\(p \cdot V \cdot T\) 相圖的差別
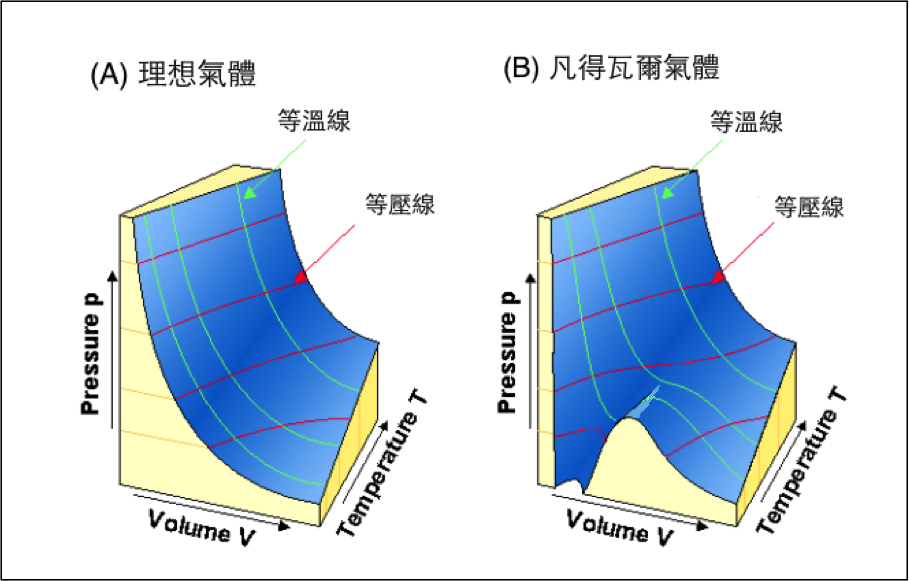
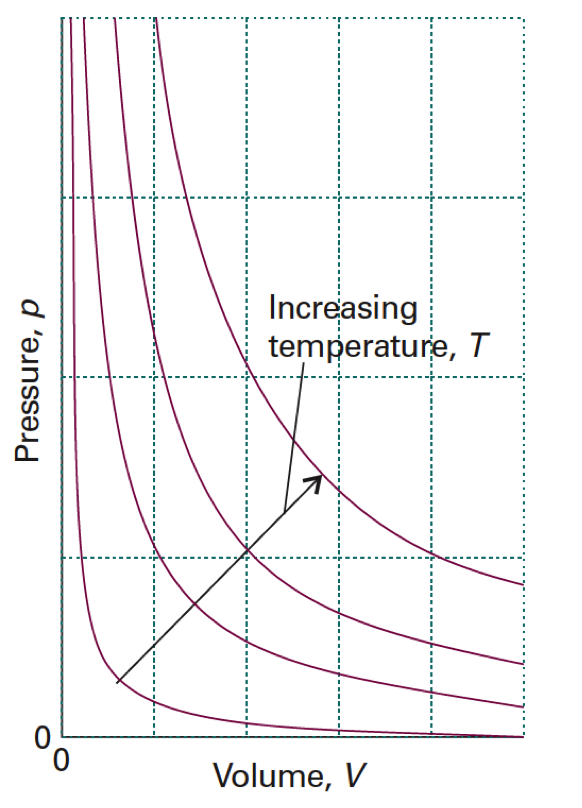
真實氣體在低溫高壓時,會有液化現象,而理想氣體粒子間並無引力存在,因此其 \(p\cdot V\cdot T\) 相圖必然和真實氣體不同。圖一為理想氣體和凡得瓦爾的 \(p \cdot V \cdot T\) 相圖,左圖 (A) 依據 \(pV = nRT\) 繪製,右圖 (B) 則依據式 \((1)\) 繪製而成。由圖中可看出 (A) 圖中的理想氣體呈現出平滑的藍色曲面,若將同一溫度下的 \(pV\) 平面和平滑曲面的交接線標示出來,即為等溫線 (isotherm),若將數條等溫線投影在 \(pV\) 面上,即得圖二的 \(pV\) 相圖。由圖一中 (B) 的部分,可看出凡得瓦爾氣體的曲面並不像 (A) 部分平順,而在低溫、低莫耳體積的地方出現有,山峰山谷的現象。若按照 (A) 部分一樣在 \(pV\) 平面上投影等溫線,則會出現類似圖三的 \(pV\) 相圖,事實上圖三是依據 \((1)\) 式,並使用 \(\mathrm{CO_2}\) 的凡得瓦爾係數:\(a=3.592~atm\cdot L^2/mol^2\)、\(b=4.267\times 10^{-2}~L/mol\),利用微軟 Excel 軟體所繪製而成。
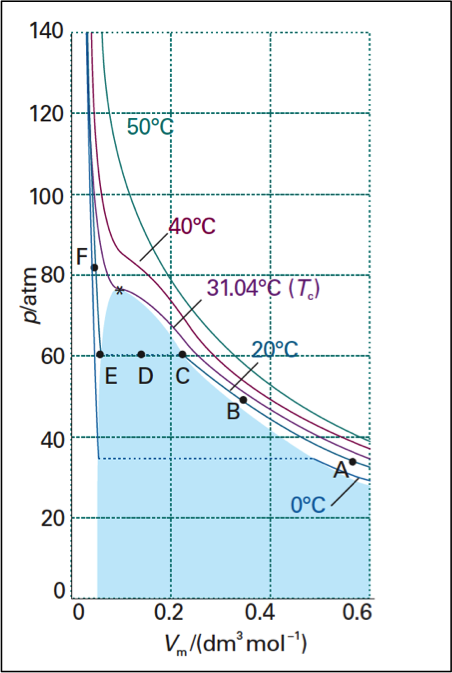
如果將圖三和實際根據實驗數據繪製而成的圖四比較,兩者十分相似,唯在臨界溫度以下,出現不一樣的情況。圖四在 \(20^\circ C\) 的等溫線,乃 \(1\) 莫耳的二氧化碳氣體裝在有活塞的容器內,當壓在活塞的壓力增大時,曲線由 (A) 點移至 (B) 點,氣體的壓力增大體積變小,但至 (C) 點時,活塞的壓力好像突然不需要再施力,便能繼續往 (D)、(E) 方向水平移動,此時氣態的二氧化碳開始液化,出現氣、液共存,一直到 (E) 點後全部液化完畢,活塞停在液面上,此時再加大壓力,曲線往上移動至 (F),唯曲線非常徏峭,和液體不易壓縮的特性相符。
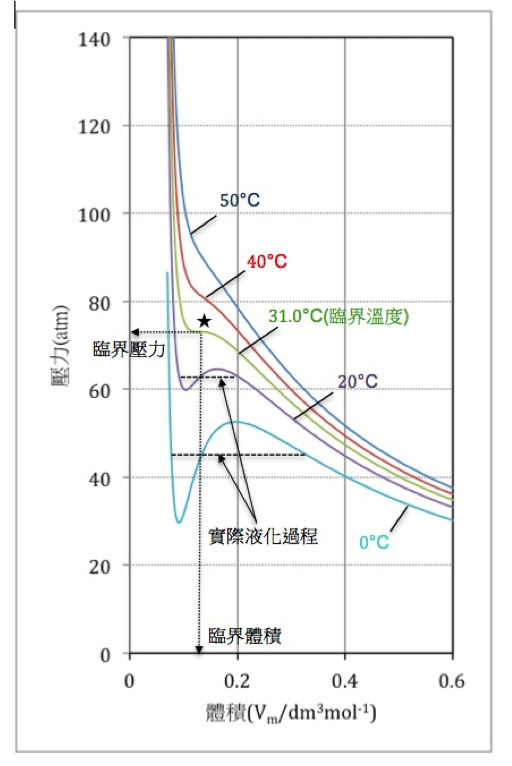
圖三\(~~~\)使用凡得瓦爾方程式,以Excel 軟體模擬二氧化碳的 \(pV\) 相圖。在 \(50^\circ C\) 的等溫線和理想氣體相似,在臨界溫度以下出現波及波谷的振盪曲線。兩條水平的虛線為實際的液化過程,並非模擬的情況。(作者自行繪製)
反觀圖三在 \(20^\circ C\) 的等溫線,隨著體積減少,壓力呈現高低起伏的現象,尤其從波峰到波谷之處,出現體積減少,壓力也跟著降著降低的現象。此與事實不符的原因,主要為凡得瓦爾方程式把粒子的交互作用,簡單的化約為粒子間具有引力使得壓力降低,而粒子活動的空間減小,則壓力增大。事實上,粒子間的交互影響及其間因距離改變而衍生出的引力、斥力關係,遠較 \((1)\) 式描述的情形複雜很多。如果在高低起伏的曲線上,畫一條水平虛線,使波谷下的面積等於波峰上的面積,恰可比擬為該等溫線下氣體液化的路徑,這樣的處理稱為麥克斯爾建構 (Maxwell construction)。
三、臨界溫度、壓力和凡得瓦爾係數的關係
圖三中使用 Excel 模擬二氧化碳相圖中的凡得瓦爾係數:\(a\)、\(b\),乃直接查表而得。事實上此為各物質的特有數值,可經由實驗值的臨界點 (critical point) 而求得。臨界點為一物質超過某一最低溫度即不可能被液化的點,此時的溫度、壓力稱為臨界溫度及壓力 (\(T_c\)、\(p_c\)),此時所對應的體積稱為臨界體積 (\(V_c\))。
由圖三 \(0^\circ C\) 的等溫線出現波峰及波谷來看,凡得瓦爾方程式在某一段範圍內,一定有極大值和極小值,可以由一次微分求得,即 \(\frac{\partial p}{\partial V_m}=0\)。當溫度上升至 \(20^\circ C\) 時,其波峰及波谷的振幅縮小並且彼此接近,若溫度繼續上升至臨界溫度時,則二者重疊出現轉折點,此時 \((1)\) 式的二次微分亦為 \(0\)。因此,先將 \((1)\) 式做一次及二次微分
\(\displaystyle\frac{\mathrm{d}p}{\mathrm{d}V_m}=-\frac{RT}{(V_m-b)^2}+\frac{2a}{V_m^3}=0\)
\(\displaystyle\frac{\mathrm{d}^2p}{\mathrm{d}V_m^2}=\frac{2RT}{(V_m-b)^3}-\frac{6a}{V_m^4}=0\)
解此二方程式,便可得臨界點(轉折點)的臨界體積及溫度,代回 \((1)\) 式,可求出臨界壓力如下:
\(\displaystyle V_c=3b~~~~~~T_c=\frac{8a}{27Rb}~~~~~~p_c=\frac{a}{27b^2}\)
現將二氧化碳由實驗測得的臨界溫度及壓力:\(303.19~K\)、\(72.8~atm\),代入上式求 \(a\) 及 \(b\)。求出之 \(a = 3.582\)、\(b = 4.269\times 10^{-2}\)、其值幾乎和查表相同,誤差在 \(1\%\) 以內。
四、總結
凡得瓦爾方程式比理想氣體方程式更貼近真實氣體,主要其考慮到氣體粒子實際活動的空間及粒子間具有吸引力,因此由各氣體獨特的臨界點引進二個參數 \(a\) 和 \(b\)。臨界點可由實驗求得,由於臨界點為各物質的特徵,各種氣體的 \(a\)、\(b\) 值當然互不相同,因此在使用上顯然比理想氣體方程式來得不方便,但卻是仍俱有解析解 (analytical solution) 的方程式,能解釋臨界點及液化現象,也能更準確的描述各類真實氣體的性質。
本文以二氧化碳氣體為例,查表將其 \(a\)、\(b\) 值代入凡得瓦爾方程式,並使用 Excel 套裝軟體繪製 \(pV\) 相圖,發現其相對應的等溫線,在臨界溫度以上幾乎和實驗所得圖形一樣。唯在臨界溫度以下,等溫線出現波峰波谷的振盪現象,會出現這種異常的情形,主要是此方程式太過簡化粒子間的所有交互作用力所致。但是若在波峰波谷的振盪處,透過麥克斯爾建構,仍可模擬其液化的過程。另外,透過圖中的臨界點(可由微分凡得瓦爾方程式求得),可由 \(a\)、\(b\) 求得臨界溫度及壓力,或以相反的步驟,由臨界溫度及壓力求出 \(a\)、\(b\) 值。
參考文獻
- Thermodynamic Potentials — Chem 201. http://casey.brown.edu/research/crp/Edu/Documents/00_Chem201/6_thermodyn_pot/6-thermodyn_pot-frames.htm
- 凡得瓦方程式 — 維基百科。http://zh.wikipedia.org/wiki/范德華方程
- Atkins, P. W. (1994) Physical Chemistry, 5th ed., p. 99~114, Oxford University Press, Oxford.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡 
