蛋白質受體辨識入侵微生物的DNA結構
蛋白質受體辨識入侵微生物的DNA結構(Structure of invading microbial DNA recognized by receptor)
國立臺灣大學生命科學系范姜文榮編譯/國立臺灣師範大學生命科學系李冠群副教授責任編輯
編譯來源:自然免疫応答を引き起こすタンパク質が微生物の侵入を感知する仕組みを解明、Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9
為對付入侵病原體如細菌或病毒,先天性免疫提供防禦的第一道防線。類鐸受體(toll-like receptor; TLR)是一類先天性免疫受體,能辨識病菌的特定分子型態,並活化免疫反應。TLR9受體(以下簡稱TLR9)會辨識細菌或病毒內具CpG模體(CpG motif)的DNA(CpG-DNA),但過去對CpG-DNA如何透過TLR9,誘發免疫刺激反應的分子機制仍不明。日本東京大學藥學研究所等研究團隊,首次成功解開能感知微生物入侵、活化先天性免疫反應的TLR9之立體結構,其研究成果於2015年2月9日刊載科學期刊「Nature」線上版。
人體具備先天性免疫機制,來防禦細菌或病毒等病原體的感染,其中TLR受體扮演重要的角色。DNA的胞嘧啶(cytosine)及鳥糞嘌呤(guanine),與正磷酸二酯體(phosphodiester)結合的DNA序列,稱作CpG模體,目前已知它在哺乳類大多出現甲基化,但在細菌或病毒則無甲基化。微生物的非甲基化CpG模體,會強烈活化TLR9,促使產生干擾素(interferon),誘發抗病毒反應等。因此在病毒感染、過敏等治療藥物或疫苗佐劑(adjuvant)的藥物開發研究,TLR9受到高度重視,但TLR9如何辨識具CpG模體的DNA序列而活化免疫反應,其詳細機制仍然不明。
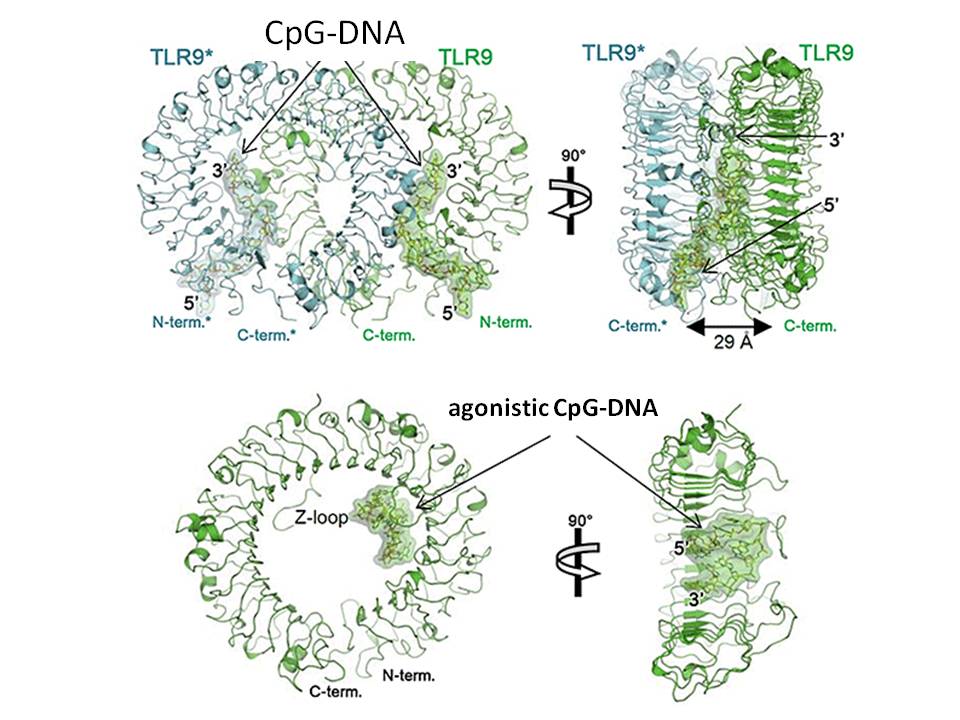
該研究團隊在細胞外大量製造蛋白質TLR9,經結晶化後,透過X光結晶解析TLR9辨識特定DNA序列的機制。結果成功解開3種TLR9型態的結晶構造,即未結合DNA的TLR9、具CpG模體DNA結合的TLR9,以及CpG模體拮抗DNA結合的TLR9。
經結構解析發現,TLR9與微生物CpG模體,會以2對2的比率形成複合物。TLR9互相結合的2分子(dimer),形成活化的m字型TLR9二聚體結構(圖一上),且CpG模體能與TLR9二聚體的N側末端凹溝鑲嵌結合。且結構展開的CpG模體,受到TLR9二聚體包夾,使得TLR9二聚體結構更加穩定。這些改變促使TLR9二聚體C側末端彼此靠近,因而傳達微生物入侵的訊息至細胞內。
另一方面,TLR9與CpG模體拮抗DNA(agonistic CpG-DNA),會以1對1的比率形成複合物(圖一下)。該拮抗DNA與TLR9馬蹄型結構的內側緻密管狀處相結合。此拮抗DNA較微生物CpG模體更能與TLR9緊密結合。經分析發現,因這些TLR9的結合處部分重疊,此拮抗DNA會阻礙微生物CpG模體與TLR9結合,造成TLR9機能受阻。
過去十幾年來的努力研究,即使瞭解TLR9能辨識微生物CpG模體,是抗病毒藥物或疫苗佐劑等的製藥重要標的,但能與特定DNA序列結合的結構型態仍未知,因此無法進行具體的化合物設計。該研究成功解析出TLR9結構,期待能對疫苗佐劑、病毒感染或過敏等的治療藥物開發有所助益。
名詞解釋
1.干擾素:為對抗細菌或病毒等病原體的入侵,免疫細胞所分泌的蛋白質,具有抑制病毒增殖、或活化免疫系統的功能。
2.佐劑:與抗原混合後投入生物體,是能增強免疫反應的物質,也被稱作抗原性補強劑。
延伸閱讀
干擾素(Interferon)
http://highscope.ch.ntu.edu.tw/wordpress/?p=7268#more-7268
DNA引發過敏反應


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 發現比地球大一點又老一點的親戚
發現比地球大一點又老一點的親戚 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  2016年的天文大小事
2016年的天文大小事  【極端氣候系列報導】(二):波波湖蒸發了
【極端氣候系列報導】(二):波波湖蒸發了  伊波拉病毒(Ebola virus)—病毒的分類與特徵(上)
伊波拉病毒(Ebola virus)—病毒的分類與特徵(上)  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應 
