多質子酸的滴定
多質子酸的滴定 (Titration of Polyprotic Acids)
國立臺灣師範大學化學系研究生 胡婷嘉
多質子酸定義為:溶於水中時,可以釋放出兩個或兩個以上氫離子的酸,如硫酸 \(\mathrm{(H_2SO_4)}\)、磷酸\(\mathrm{(H_3PO_4)}…\)等,而單質子酸,是溶於水中時只能釋放出一個氫離子的酸,如鹽酸\(\mathrm{(HCl)}\)、硝酸\(\mathrm{(HNO_3)}\)。1
在一般的滴定實驗中,常用到的是具有單一氫氧根的鹼來滴定單質子酸、且皆為強解離的酸鹼,因為氫氧根離子和氫離子會以一比一的比例中和,容易計算;多質子酸的滴定較為少見的原因,主要是因為多質子酸釋放出第一個氫離子後,要釋放第二個氫離子以上的難度不一,要視 \(pK_{a2}\) 來決定,增加了計算的困難度。2但其實要計算多質子酸滴定時的 \(p\mathrm{H}\) 值的方法和單質子酸的原理是一樣的,只需考慮多質子酸因依序釋放出氫離子,所造成的細節改變1.4.5。
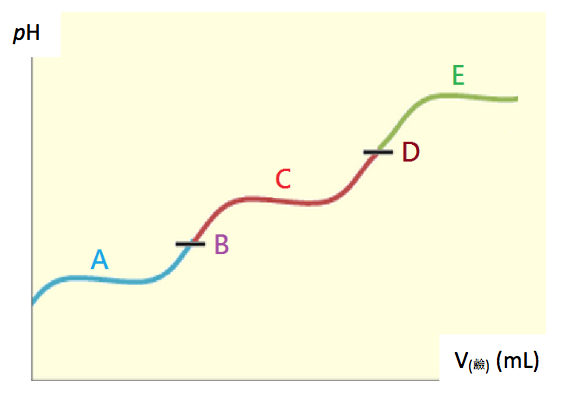
以酸為 \(\mathrm{H_2A}\) 的滴定曲線為例,先假設它的 \(K_{a1}/K_{a2}>10^3\),此時,每一段的解離不會被其他段解離影響,可以得到多個滴定終點1,如下圖一:
藍色的 \(A\) 範圍就是從滴定開始到第一個當量點之前,由下列的式一,可知 \(A\) 範圍內的主要物質是 \(\mathrm{H_2A}\) 和 \(\mathrm{HA^-}\)。此時的 \(p\mathrm{H}\) 值可以由 \(K_{a1}\) 得到。
\(\mathrm{H_2A+H_2O\rightleftharpoons H_3O^++HA^-}\)
\(K_{a1}=\mathrm{\displaystyle \frac{[H_3O^+][HA^-]}{[H_2A]}}~~~~~~\)式一
在第一當量點 \(B\) 時,主要的物質是 \(\mathrm{HA^-}\) 和 \(\mathrm{H_2O}\),但是因為 \(\mathrm{HA^-}\) 是一個兩性物質,在水中可以當酸(式二)或當鹼(式三)。
\(\mathrm{HA^-+H_2O\rightleftharpoons A^{2-}+H_3O^+}~~~~~~\)式二
\(\mathrm{HA^-+H_3O^+\rightleftharpoons H_2A+H_2O}~~~~~~\)式三
把兩個式子相加,變成式四:
\(\mathrm{2HA^-\rightleftharpoons H_2A+A^{2-}}~~~~~~\)式四
而這個式子的平衡常數 \(K\) 則為 \(K=\displaystyle\mathrm{\frac{[H_2A][A^{2-}]}{[HA^-]^2}}\),可以拆成
\(\mathrm{\displaystyle \frac{[H_2A]}{[HA^-]}\times\frac{[A^{2-}]}{[HA^-]}=\frac{K_{a2}}{[H^+]}\times\frac{[H^{+}]}{K_{a1}}=\frac{K_{a2}}{K_{a1}} }\)
要算氫離子的濃度時,要在看回溶液中有哪些主要物質,由式四可以知道 \(\mathrm{H_2A}\) 和 \(\mathrm{A^{2-}}\) 是一比一生成的,所以他們倆個的濃度一樣,就可以把平衡常數 \(K\) 簡化成,\(K=\mathrm{\frac{[H_2A]^2}{[HA^-]^2}}\),要算 \(p\mathrm{H}\) 值必須知道他的氫離子濃度,由 \(K_{a1}\) 可以知道
\(\displaystyle p\mathrm{H}=-\log[\mathrm{H_3O^+}]=-\log (K_{a1}K_{a2})^{1/2}=\frac{pK_{a1}+pK_{a2}}{2}\)
由一連串的推導,我們可以把第一當量點的 \(p\mathrm{H}\) 值簡化成用 \(pKa_1\) 和 \(pKa_2\) 表示。
由一樣的推導可知,若被滴定的酸為三質子酸的話,第二當量點的 \(p\mathrm{H}\) 值為 \(\frac{pK_{a2}+pK_{a3}}{2}\)
紅色的 \(C\) 範圍就是從第一個當量點到第二個當量點之間,主要的物質是 \(\mathrm{A^{2-}}\) 和 \(\mathrm{HA^-}\),
此時的 \(p\mathrm{H}\) 值可以由 \(K_{a2}\) 計算出來。
\(\mathrm{HA^-+H_2O\rightleftharpoons H_3O^++A^{2-}}\)
\(K_{a2}=\mathrm{\displaystyle \frac{[H_3O^+][A^{2-}]}{[HA^-]}}~~~~~~\)式五
在第二當量點 \(D\) 時,大部分的物質為 \(\mathrm{A^{2-}}\),因為 \(\mathrm{A^{2-}}\) 不像 \(\mathrm{HA^-}\) 可以當酸和鹼,
所以由 \(K_b\) 即可算出 \(p\mathrm{H}\) 值。
\(\mathrm{A^{2-}+H_2O\rightleftharpoons HA^-+OH^-}\)
\(K_{b}=\mathrm{\displaystyle \frac{[OH^-][HA^-]}{[A^{2-}]}}\)
如果不知道 \(K_b\) 的話可以由 \(K_{a2}\) 計算出來(式六)。
\(\begin{array}{ll} K_{a2}K_b &=\mathrm{\displaystyle \frac{[H_3O^+][A^{2-}]}{[HA^-]}\frac{[OH^-][HA^{-}]}{[A^{2-}]}=[H_3O^+][OH^-]}=K_w\\&\displaystyle\rightarrow K_b=\frac{K_w}{K_{a2}}\end{array}\) 式六
而最後綠色的範圍 \(E\),因為酸中和完畢,所以 \(p\mathrm{H}\) 值就由過量的鹼來決定。
以例題為計算例子:
\(*\) 在燒杯中有 \(100\) 毫升的 \(\mathrm{H_2B}\) \((Ka_1= 10^{-4}, Ka_2= 10^{-7})\),濃度為 \(0.1~M\)。用 \(0.1~M\) 的 \(\mathrm{NaOH}\) 滴定。
- 一開始的 \(p\mathrm{H}\) 值?
- 加 \(50\) 毫升 \(\mathrm{NaOH}\) 的 \(p\mathrm{H}\) 值?
- 加 \(100\) 毫升 \(\mathrm{NaOH}\) 的 \(p\mathrm{H}\) 值?
- 加 \(150\) 毫升 \(\mathrm{NaOH}\) 的 \(p\mathrm{H}\) 值?
- 加 \(200\) 毫升 \(\mathrm{NaOH}\) 的 \(p\mathrm{H}\) 值?
- 加 \(250\) 毫升 \(\mathrm{NaOH}\) 的 \(p\mathrm{H}\) 值?
因 \(Ka_1/Ka_2\) 大於 \(10^{3}\),所以可以用上述的方法來計算 \(p\mathrm{H}\) 值:
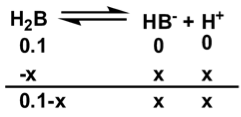
\((1)\) 一開始沒有加 \(\mathrm{NaOH}\) 時,溶液中的主要成分為 \(\mathrm{H_2B}\) 及 \(\mathrm{HB^-}\)
\(K_{a1}=\displaystyle\mathrm{\frac{[H_3O^+][HB^-]}{[H_2B]}=\frac{x^2}{0.1-x}}\)
又 \(x\) 比 \(0.1\) 小很多,所以 \(0.1-x\) 約等於 \(0.1\),
移項之後可得,\(x=\sqrt{(K_{a1}\cdot 0.1)}\)
\(\underline{p\mathrm{H}=-\log X=2.5}\)
\((2)\) 加 \(50\) 毫升的 \(\mathrm{NaOH}\) 時,是在從滴定開始到第一個當量點之前,
所以由 \(\displaystyle\mathrm{[H_3O^+]}=K_{a1}\cdot \mathrm{\frac{H_2B}{HB^-}}\)
又 \(\mathrm{H_2B\rightleftharpoons HB^-+H^+}\),\(\mathrm{H_2B}\) 被多少 \(\mathrm{NaOH}\) 消耗,所生成的 \(\mathrm{HB^-}\) 就會有多少,
所以 \(\mathrm{H_3O^+}\) 的濃度為 \(\displaystyle 10^{-4}\cdot \frac{(100\cdot 0.1-50\cdot 0.1)/100+50}{50\cdot 0.1/100+50}=10^{-4}\)
其 \(\underline{p\mathrm{H}=-\log [\mathrm{H_3O^+}]=4 }\)
\((3)\) 加 \(100\) 毫升 \(\mathrm{NaOH}\) 時,\(\mathrm{OH^-}\) 的莫耳數和 \(\mathrm{H^+}\) 一樣多,是第一當量點,
\(\displaystyle\underline{p\mathrm{H}=\frac{(pK_{a1}+pK_{a2})}{2}=\frac{(4+7)}{2}=5.5 }\)
\((4)\) 加 \(150\) 毫升 \(\mathrm{NaOH}\) 時,此時在第一和第二當量點之間,
主要的物質為 \(\mathrm{HB^-}\) 和 \(\mathrm{B^{2-}}\),
所以我們由下式可知 \(\underline{p\mathrm{H}=7 }\)。
\(\displaystyle \mathrm{[H_3O^+]}=K_{a2}\cdot \mathrm{\frac{[B^{2-}]}{[HB^-]}}=10^{-7}\cdot\frac{(100\cdot 0.1-50\cdot 0.1)/100+150}{50\cdot 0.1/100+150}=10^{-7}\)
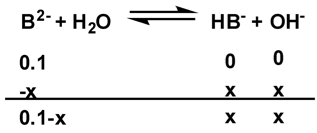
\((5)\) 加 \(200\) 毫升 \(\mathrm{NaOH}\),為第二個當量點,
此時主要的物質為 \(\mathrm{B^{2-}}\) 和 \(\mathrm{H_2O}\),要知道 \(p\mathrm{H}\) 值,可以從 \(K_b\) 得到,
離子變化量如下列算式所示:
而其中 \(K_{b}=\displaystyle\mathrm{\frac{[HB^-][OH^-]}{[B^{2-}]}=\frac{x^2}{0.1-x}}\) ,又 \(x\) 遠小於 \(0.1\),
所以 \(0.1-x\) 約等於 \(0.1\),代入:\(K_b=10^{-7}=x^2/0.1\),\(x = 10^{-4}\)
\(\displaystyle\underline{p\mathrm{H}=14-p\mathrm{OH}=14-(-\log 10^{-4})=10}\)
\((6)\) 加 \(250\) 毫升 \(\mathrm{NaOH}\),此時酸都已經被 \(\mathrm{NaOH}\) 給中和完了,
剩下的 \(\mathrm{OH^-}\) 及 \(\mathrm{H_2O}\) 是決定 \(p\mathrm{H}\) 值的主要物質,
\(\displaystyle\mathrm{[OH^-]=\frac{250\cdot 0.1-200\cdot 0.1}{100+250}=0.01428}\)
\(\displaystyle\underline{p\mathrm{H}=14-p\mathrm{OH}=14-(-\log 0.01428)=12.2}\)
參考文獻
- Skoog D.A., Wes D.M,Holler F.J., Crouch S.R.,(2004) Analytical Chemistry (8ed), P399-415
- 當酸性物質跳水進入鹼性游泳池中—酸鹼滴定。
http://www.shs.edu.tw/works/essay/2008/10/2008102921034737.pdf - 多質子酸的滴定 Titration of Polyprotic Acids 2-1|加百列的部落格。
http://classic-blog.udn.com/Gabriel33/5347196 - 多質子酸的滴定 Titration of Polyprotic Acids 2-2|加百列的部落格。
http://classic-blog.udn.com/Gabriel33/5347205 - Applications of Aqueous Equilibria 第八章 水溶液平衡的運用。
http://ocw.aca.ntu.edu.tw/ocw_files/099S125/ch08.pdf


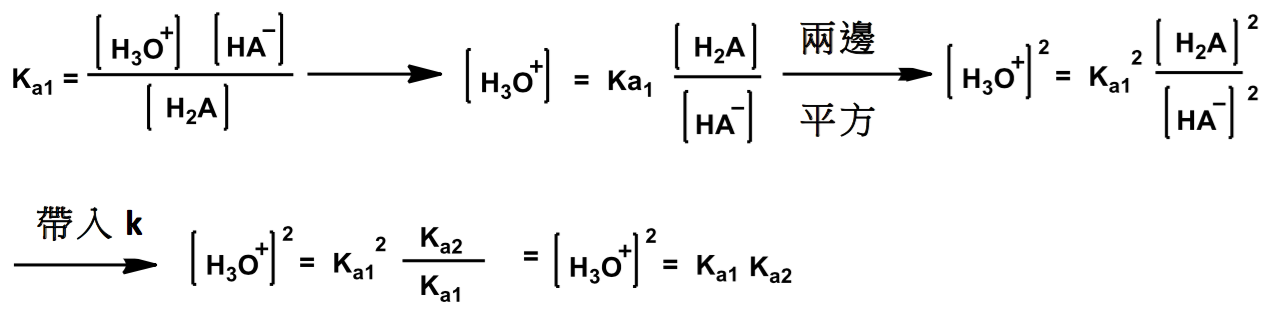
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  暖暖包的原理
暖暖包的原理  化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體 

因為ka1/ka2 > “10^(-3)”,所以可以用上述的方法來計算pH值
是10^3才對吧?
由式四可以知道 H2A和 A2−是一比一生成的,所以他們倆個的濃度一樣
這句話應該是錯誤的
式二的Ka2和式三的Kb2並不相等 同一杯水溶液中的H2A和 A2−濃度不會相等