鹵化銀(二)
鹵化銀(二)Silver Halide(II)
國立臺灣師範大學附屬高級中學 蔡韶恬
連結: 鹵化銀(一)
氯化銀 $$\mathrm{(AgCl)}$$
氯化銀為白色結晶固體,難溶於水,熔點為 $$455^\circ C$$,自然界所存在的角銀礦 (chlorargyrite)。照光或受熱後會分解為銀及氯氣,變質的氯化銀外觀會呈現灰色或紫色。
製備:
將硝酸銀與氯化鈉兩種溶液混合後可得到氯化銀,
$$\mathrm{AgNO_{3(aq)}+NaCl_{(aq)}}{\longrightarrow}\mathrm{AgCl_{(s)}+NaNO_{3(aq)}}$$
氯化銀不會與硝酸反應,水溶液中的氯化銀沉澱可加入某些物質使其溶解,如:$$\mathrm{Cl^-}$$、$$\mathrm{CN^-}$$、三苯基膦、$$\mathrm{{S_2O_3}^{2-}}$$ 及 $$\mathrm{NH_3}$$,這是因為它們可作為配位基與氯化銀形成錯離子,反應式列舉如下:
$$\mathrm{AgCl_{(s)}+{Cl^{-}}_{(aq)}}{\longrightarrow}\mathrm{{AgCl_2^{-}}_{(aq)}}$$
$$\mathrm{AgCl_{(s)}+{2S_2O_3}^{2-}_{(aq)}}{\longrightarrow}\mathrm{[Ag(S_2O_3)_2]^{3-}_{(aq)}+Cl^{-}_{(aq)}}$$
$$\mathrm{AgCl_{(s)}+2NH_{3(aq)}}{\longrightarrow}\mathrm{[Ag(NH_3)_2]^+_{(aq)}+Cl^-_{(aq)}}$$
由氯化銀衍生的錯合物有二配位、三配位及很少見的四配位,形狀分別為線性、平面三角形及四面體。
將無色的硝酸銀溶液與氯化鈉溶液混合,可產生不透明的白色氯化銀沉澱,此為最著名的化學反應之一,因其顯而易見的變化,可利用此法檢測溶液中是否有氯離子,用在滴定分析上則屬於銀量法 (argentometry) 的一種。
室溫下氯化銀在水中的溶度積為 $$1.77\times 10^{-10}$$,溶解度約為 $$1.9~ppm$$。由於氯化銀是少數不會與水反應的過渡金屬氯化物,不具吸水性,因此藉由滴定法可方便地將氯化銀沉澱秤重,計算出溶液中氯離子濃度。會干擾這類檢測的離子有溴離子及碘離子,以及前述會提高鹵化銀溶解度的各種配位基。
氯化銀暴露於照光中會崩解為元素態的氯及銀,因而快速變黑,攝影及底片即為此反應的應用,也用在光致變色鏡片中。
用途:
氯化銀的用途很廣,銀-氯化銀電極是電化學中常用的參考電極,氯化銀可作為汞中毒的解毒劑,有助於將汞排出體外。此外可用在繃帶敷料及創傷治療產品,以及微生物抑制劑,如個人用的防臭劑,或是提供飲用水儲水槽中長期的保護。
溴化銀 $$\mathrm{(AgBr)}$$
溴化銀是質軟、淡黃色,在水中難溶的鹽類,可在溴銀礦中發現,光敏性極高,更甚氯化銀,廣用於攝影底片,也因此讓鹵化銀成為現代攝影物質的根基。
製備:
雖然存在於礦物中,溴化銀主要是將硝酸銀溶液與鹼金屬溴化物(如溴化鉀)反應製得,如下式,亦可由成分元素來製備,但較不方便。
$$\mathrm{AgNO_{3(aq)}+KBr_{(aq)}}{\longrightarrow}\mathrm{AgBr_{(s)}+KNO_{3(aq)}}$$
性質:
溴化銀可迅速與氨水反應,形成多樣的氨錯合物,例如:
$$\mathrm{AgBr+nNH_3}{\longrightarrow}\mathrm{Ag(NH_3)_2^{1+}}$$
進而形成 $$\mathrm{\{AgBr(NH_3)_2\}}$$,$$\mathrm{\{AgBr_2(NH_3)_2\}^{1-}}$$,$$\mathrm{\{AgBr(NH_3)\}}$$,$$\mathrm{\{AgBr_2(NH_3)\}^{1-}}$$
應用:
目前簡便式光敏表面的製作方式,是在明膠表面形成鹵化銀晶體的感光乳劑,再塗佈於底片或其他底質上。在特定條件的環境下藉由沉澱形成晶體,以得到直徑小於 $$1~\mu m$$,含大約 $$10^{12}$$ 個銀原子大小的微粒。
碘化銀 (AgI)
碘化銀是鮮黃色的固體,但因具高度光敏性,常混雜被還原析出的銀金屬而呈現灰色。
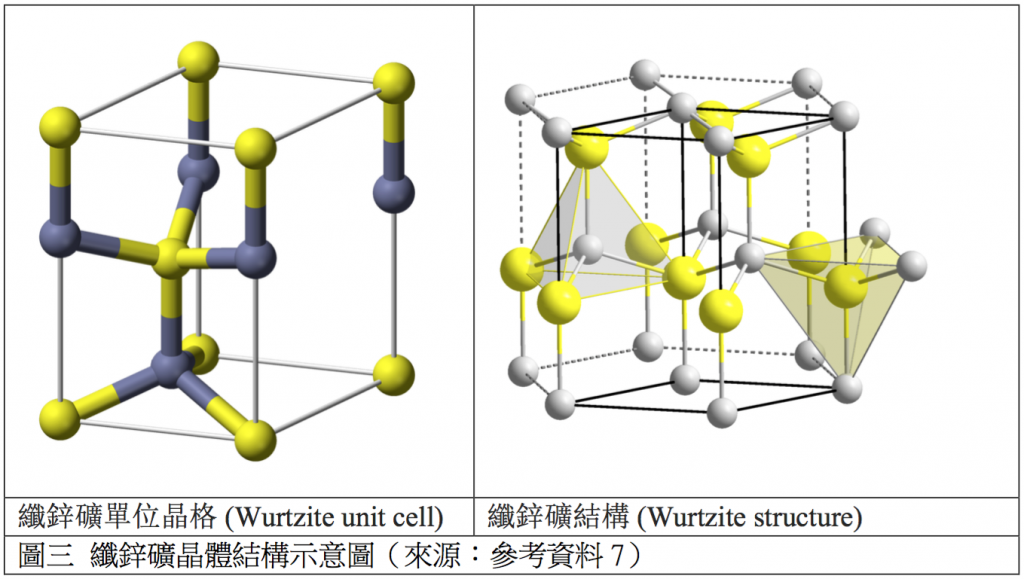
碘化銀的結構與溫度有關。當溫度低於 $$420~K$$,具有纖鋅礦結構 (wurtzite structure) 的 $$\beta$$-相態碘化銀最穩定,此相態可在自然界中的碘銀礦中發現。溫度高於 $$420~K$$ 時,則是 $$\alpha-$$相態較穩定,此型態是以銀原子為中心的體心立方晶系。在此溫度下,銀離子可在固體間快速移動,產生快離子傳導 (fast ion conduction) 現象。
製備:
將含碘離子溶液(如碘化鉀)與含銀離子溶液(如硝酸銀)混合,可迅速形成黃色的碘化銀沉澱,此固體為前述兩種主要相態的碘化銀混合物。將碘化銀溶解在氫碘酸中,再以水稀釋可得 $$\beta$$-相態碘化銀;若將碘化銀溶在濃硝酸銀中,再以水稀釋則可得到 $$\alpha$$-相態碘化銀。要小心的是,若製備過程未避光,照光將導致銀離子還原成金屬,所得之固體產物會迅速變黑。
應用:
碘化銀可用在抗菌及人造雨。$$\beta$$-相態碘化銀的晶體結構與冰相似,因此可用在人造雨中,藉由異質成核過程誘發水的凝固。每次人造雨的實驗大約消耗 $$10$$~$$50$$ 克,年消耗大約為 $$50,000$$ 公斤。
安全性:
過度暴露在碘化銀的環境中可能導致銀沉著症 (argyria),其特徵是身體組織內的銀經過陽光曝曬後會局部呈現藍或藍黑的顏色。
參考文獻
- Silver bromide — Wikipedia.(檢索日期2015/06/10)http://en.wikipedia.org/wiki/Silver_bromide
- Silver chloride — Wikipedia.(檢索日期2015/05/15)http://en.wikipedia.org/wiki/Silver_chloride
- Silver fluoride — Wikipedia.(檢索日期2015/05/12)https://en.wikipedia.org/wiki/Silver(I)_fluoride
- Silver halide — Wikipedia.(檢索日期2015/05/05)http://en.wikipedia.org/wiki/Silver_halide
- Silver Iodide — Wikipedia.(檢索日期2015/06/15)https://en.wikipedia.org/wiki/Silver_iodide
- Cotton, F. A., Wilkinson, G., Murillo, C. A., Bochmann, M., & Grimes, R. (1999). Advanced inorganic chemistry (Vol. 1355). New York: Wiley.
- Wurtzite crystal structure — Wikipedia. https://en.wikipedia.org/wiki/Wurtzite_crystal_structure


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 強化玻璃
強化玻璃  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第? ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破 
