諾爾吡咯合成法
諾爾吡咯合成法 (Knorr Pyrrole Synthysis)
國立臺灣師範大學化學系碩士生 高勤為
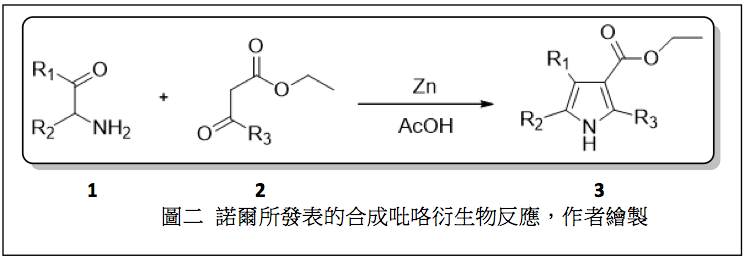
路德維希.諾爾 (Ludwig Knorr) 是德國著名的有機化學家(圖一),首先發表了一個常用的合成吡咯衍生物的有機反應,此反應是利用 $$\alpha-$$氨基酮 (1) 和具有更強 $$\alpha-$$活潑氫的 $$\beta-$$酮酯 (2) 或 $$\beta-$$二酮類化合物反應在鋅和乙酸的存在下,在室溫進行縮合反應,得到吡咯和其衍生物(圖二)。1-5
1. 生平簡介:
路德維希.諾爾(1859 年 12 月 2 日至 1921 年 6 月 4 日)
1859 年出生於一個富裕的家庭
1878 年,求學於慕尼黑大學化學系,剛開始向雅各佛爾哈德 (Jacob Volhard) 教授學習,而後因佛爾哈德教授前往埃爾蘭根大學 (University of Erlangen) 轉而加入赫爾曼.埃米爾.費歇爾 (Hermann Emil Fischer) 教授的團隊學習。
1880 年的夏天,與羅伯特.威廉.本生 (Robert Wilhelm Bunsen) 一起在海德堡大學 (University of Heidelberg) 進行研究。當埃米爾·菲舍爾成為了埃爾蘭根大學教授,諾爾成為其博士生。
1882 年,拿到博士學位
1883 年,合成止痛藥物安替比林 (antipyrine),現在叫安替比林(Phenazone)。安替比林是第一個使用最廣泛的合成藥物,但在 20 世紀初被阿斯匹靈所取代。
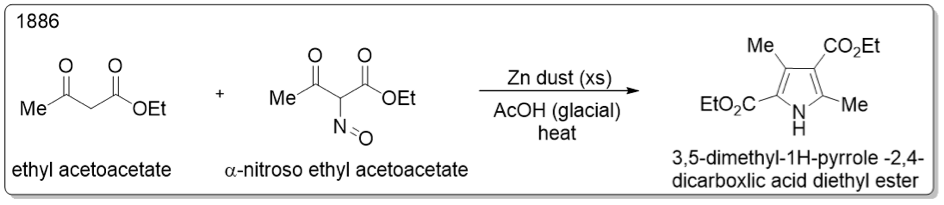
1886 年,諾爾教授將 $$\alpha-$$亞硝基乙醯乙酸乙酯和乙醯乙酸乙酯混和並加入鋅粉和冰醋酸加熱反應,形成四取代的吡咯衍生物(圖三)。
2. 諾爾吡咯合成反應 (Knorr pyrrole synthesis):
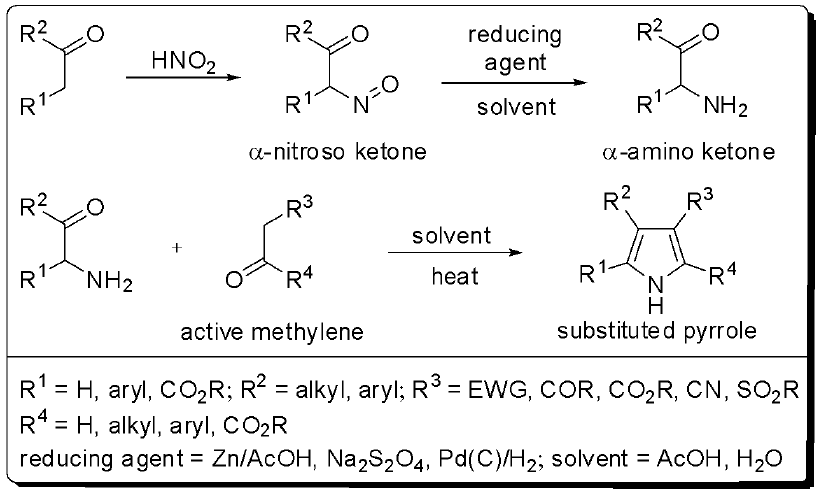
將酮基與亞硝酸進行還原反應,得到 $$\alpha-$$胺基$$\beta-$$酮酯再與乙醯乙酸酯反應,得到多取代之吡咯衍生物。將$$\alpha-$$胺基酮或 $$\alpha-$$胺基 $$\beta-$$酮酯和活化的亞甲基的化合物被稱為諾爾吡咯的合成。
反應的進行可以在酸性或鹼性環境下。而因初產物 $$\alpha-$$胺基酮相當不穩定,其容易進行自縮合反應生成吡嗪 (pyrazine),其常見的合成方法是先對酮進行亞硝化,反應得到 $$\alpha-$$亞硝基酮立即進行還原反應。此還原反應可以使用鋅粉並在醋酸溶液的環境下,或是低亞硫酸鈉溶液中(其為強還原劑的一種),或是氫化還原。
而因為 $$\alpha-$$胺基酮的不穩定容易形成自縮合反應,故有幾種方法來避免,其中一種是讓 $$\alpha-$$胺基酮形成氯化氫的 $$\alpha-$$胺基酮鹽類,此化合物是相對穩定的,可直接利用進行反應並回收鹽酸;另一種利用羰基的保護基–縮醛做為 $$\alpha-$$胺基酮的取代基,來避免 $$\alpha-$$胺基酮進行自縮合反應。
特別的是可以利用二級的胺基酮得到氮上有取代的吡咯衍生物。若是活化的亞甲基反應性不夠,將會導致吡咯衍生物生成緩慢,而 $$\alpha-$$胺基酮的自縮合反應為主要的反應途徑,故亞甲基通常使用 1,3- 二酮 (1, 3-diketone),$$\beta-$$酮酯 ($$\beta-$$ketoester) 或 $$\beta-$$氰基酯 ($$\beta-$$cyanoester)。(圖四)
3. 反應機構:
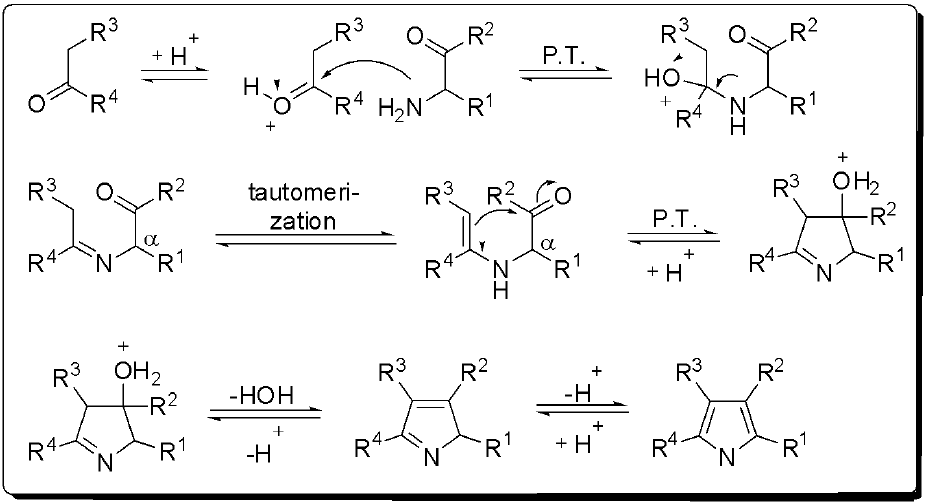
首先將胺基酮與酮進行縮和反應,形成亞胺基 (imine) 的化合物,其異構化形成烯胺基、再進行合環的反應,最後再脫水並芳香化得到吡咯衍生物。(圖五)
4. 應用:
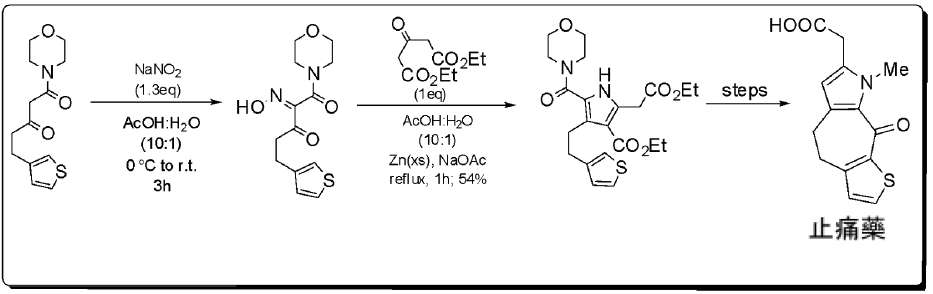
產物是一種新的消炎止痛藥,4,5,8,9 四氫-8-乙基-9-過氧噻吩並[3’,3’:5,6] 環庚並 [1,2-B]-吡咯-7-乙酸,其經由諾爾吡咯合成的高度取代,利用 $$\beta-$$酮醯胺進行亞硝化並在乙酸/水的條件中,得到相應的 $$\alpha-$$肟基酮 ($$\alpha-$$oximino ketone)。再加入二丙酮-1,3-二甲酸、鋅粉和乙酸鈉,進行迴流加熱,來進行三環酮的環化。(圖六)
參考文獻
- Ludwig Knorr — Wikipedia. https://en.wikipedia.org/wiki/Ludwig_Knorr
- Knorr pyrrole synthesis — Wikipedia. https://en.wikipedia.org/wiki/Knorr_pyrrole_synthesis
- Kurti, L., & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis. Elsevier. pp.244-245
- Pyrrole — Wikipedia. https://en.wikipedia.org/wiki/Pyrrole
- Paal-Knorr pyrrole synthesis — Organic Chemistry Portal. http://www.organic-chemistry.org/namedreactions/paal-knorr-pyrrole-synthesis.shtm
- Rede von Prof. Dr. Kay Brune aus Anlass der Einweihung des Neubaus des Institutes für Experimentelle und Klinische Pharmakologie und Toxikologie am 11. Oktober 1999. — Institut für Experimentelle und KlinischePharmakologie und Toxikologie. http://pharmakologie.uni-erlangen.de/ueber-das-institut/geschichte.shtml



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡 
