神奇的氫氟酸
神奇的氫氟酸(Hydrofluoric Acid)
臺北市立第一女子高級中學二年級陳怡潔/臺北市立第一女子高級中學化學科詹莉芬老師修改/國立臺灣師範大學化學系葉名倉教授責任編輯
氫氟酸的基本性質
氟化氫(Hydrogen fluoride),化學式為HF,實驗室可以由氟石(CaF2)與濃硫酸混合加熱至250℃,利用蒸餾法收集沸點較低的HF(g),HF(g)是無色、有劇毒、強腐蝕性氣體。加水之後即成為氫氟酸HF(aq)。
反應式如下:
2CaF2(s)+H2SO4 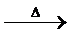 2HF(g)+CaSO4(s)
2HF(g)+CaSO4(s)
氫氟酸在水中的解離度不大,是一種弱酸
HF(aq)→H+(aq)+F-(aq) Ka≒7×10-4
但是當濃度很高濃度時,氫氟酸產生下列反應:
2HF(aq)→H+(aq) +[FHF]-(aq)
[FHF]-內具有特殊的氫鍵,有利於平衡向右,使得氫氟酸搖身一變成為強酸。
氫氟酸應用
1.溶解玻璃
氟是人類已知活性最大的元素,它會和Si及SiO2可形成極強的Si-F化學鍵,反應過程如下:
SiO2+4HF→SiF4(g)↑+2H2O
SiO2+6HF→H2[SiF6](aq)+2H2O
因為這一項特性,氫氟酸常用於加工玻璃。首先,在玻璃上抹上一層石蠟,再用刀子劃破蠟層,塗上氫氟酸,待一段時間的作用後,洗去殘餘的氫氟酸和蠟質,便大功告成。舉凡實驗室燒杯的刻度、玻璃窗的花紋,都是這樣產生的。
也因此氫氟酸是唯一不可存放於玻璃容器中的酸,必須貯存在塑膠容器中(譬如聚四氯乙烯、聚乙烯材料)。
2.工業應用
氫氟酸具有很好的溶解氧化物,使得氫氟酸的應用十分廣泛,小至家庭除銹劑、光亮劑的成份,大至製陶業、大理石洗滌、鋼鐵除鏽等用途。
氫氟酸具有很好的腐蝕二氧化矽或矽元素的能力,半導體工業使用它來去除矽表面的氧化物,利用浸蝕、清洗、刻劃等方法標記製作各式各樣的矽晶片,可說是現代半導體工業中非常重要的危險物品。
氫氟酸可做為將丁烯或丙烯烷基重組為異丁烷的催化劑,只要在0-30℃的條件,氫氟酸提供H+與烯類反應形成高活性的碳陽離子(carbocations),烷基結構就重組形成異丁烷,此反應設計的好處是反應物和催化劑屬於兩相,方便產物之分離,且由於低溫進行,不易有其他副反應發生,使得此反應之轉化率很高。
氫氟酸灼傷中毒-傳說中的化骨水
一般人體可能接觸到的氫氟酸,屬於低濃度的弱酸,對皮膚刺激性較低,導致患者在初期症狀不明顯,容易延誤治療。氟化氫灼傷中毒症狀有以下幾點:
體表組織腐蝕性傷害,包括皮膚表面灼傷、紅腫,針刺痛感,甚長水泡。
由於解離出來的F-很小,對皮膚組織有高度穿透性,很容易穿過細胞膜到達組織深部,與體內血液中的鈣、鎂等陽離子結合,產生不可溶的氟化鈣或氟化鎂等鹽類沈澱物或生理電解質不平衡,甚至造成骨骼脫鈣,威力如同武俠小說中的「化骨水」
氫氟酸會抑制細胞膜上控制鈉、鉀幫浦的腺核甘三磷酸脢(ATPase),引起大量鉀離子流到細胞外。如此不僅造成局部疼痛、血鉀上升,還可能干擾神經傳導及心臟收縮,而產生致命的心律不整及心跳停止。此乃氫氟酸灼傷最可怕的併發症。
[急救]氫氟酸灼傷中毒的解毒劑是葡萄糖酸鈣凝膠,將受傷地方大量清水沖洗後後立即塗於患部。參考資料
http://zh.wikipedia.org/zh-tw/%E6%B0%A2%E9%94%AE(氫鍵)
http://tw.knowledge.yahoo.com/question/question?qid=1306051502593(HF是強酸)
http://www.pcc.vghtpe.gov.tw/old/docms/41002.htm
http://subject.skhlkyss.edu.hk/chem/reading_fluorine.htm
http://www.tahsda.org.tw/article/news.php?id=3&name=plastic
http://zh.wikipedia.org/zh-tw/%E6%B0%A2%E6%B0%9F%E9%85%B8


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  中間體與穩定狀態近似法
中間體與穩定狀態近似法  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  化學傳記:法拉第不為人知的一面(八):電解定律
化學傳記:法拉第不為人知的一面(八):電解定律  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
