混成軌域
混成軌域 (Hybridized Orbitals)
國立臺灣師範大學化學系邱緯航研究生/國立臺灣師範大學化學系葉名倉教授責任編輯
一、概論
在化學這門領域中,混成(hybridization)主要的概念是將多個原子軌域混合形成新的混成軌域(hybridized orbitals),它能用來定性地描述原子間鍵結的性質。除此之外,混成軌域在解釋分子的分子軌域形狀時非常有用,也通常與價層電子對互斥理論(valence shell electron-pair repulsion (VSEPR) theory)共同來解釋分子的形狀。
二、歷史沿革
混成理論是化學家萊納斯.鮑林(Linus Pauling)於1931年時提出的,當時他是為了要解釋甲烷(CH4)的簡單分子結構。本來這個概念主要是拿來解釋簡單的分子結構,不過這個方法被使用地越來越廣泛,以至於到今天已經成為一個有效而可以拿來合理化解釋各種有機化合物結構的方法。
軌域是一個能表現出電子在分子間行為的模型。就簡單的混成而言,它的估測主要是基於原子軌域,類似於氫原子所得到的結果,也是利用已知的薛丁格方程式(Schrodinger equation)精確計算出來的。若是對於重原子來說,像是碳、氮和氧,它們的原子軌域主要是利用2s及2p軌域,類似氫原子的激發態。混成軌域一般是假設為許多原子軌域的組合,以不同的比例疊加而成。混成軌域不一定要拿來描述分子,只不過對於那些利用碳、氮和氧(或少數含有硫、磷)所組成的分子來說,混成理論是可以讓分子結構的解釋更為簡單。
三、混成種類(不含d軌域的參與)
(1) sp3 混成(sp3 hybrids)
對於以正四面體的方式配位的碳原子來說,例如甲烷(methane,分子式CH4),它必須有四個軌域去鍵結四個氫原子。碳的基態電子組態是1s2 2s2 2px1 2py1:
以共價理論去預測,發現有兩個半填滿的p軌域,故碳可以與氫原子形成兩個共價鍵,即CH2。但是 CH2是活性非常高的分子,不可能單獨存在,也因此共價理論無法解釋甲烷的存在。除此之外,基態的電子軌域亦無法用於CH4的鍵結,但是當激發一個2s軌域的電子至2p軌域時,就能夠根據共價理論允許四個鍵結,也暗示著CH4四個鍵結因為有來自不同軌域的能階重疊而有不同的能量,不過有實驗駁斥了這個說法,也就是從CH4拔掉任何一個碳上的氫其實都是一樣容易的,所以也間接說明此四個鍵的能量其實是相等。
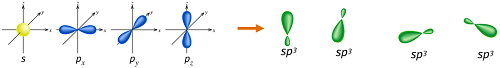
所以我們先以甲烷的例子來看,首先混成的第一步是碳會被激發一個2s軌域的電子至2p軌域,如下圖所示:
就碳必須鍵結四個氫而言,必須要有四個鍵結軌域。因此,碳的2s 軌域(內層軌域的1s電子幾乎不會拿來做鍵結) 會與三個2p軌域進行混成形成四個sp3混成軌域,即:
此時,這四個sp3混成軌域即可與氫原子的1s 軌域交疊,得到四個σ(sigma)鍵,也就是四個單鍵,且此四個鍵的長度及強度均相等,分子形狀為正四面體(tetrahedral)。
(2) sp2 混成(sp2 hybrids)
其他以碳為主的化合物或分子都能以類似甲烷的方式去解釋。又例如乙烯(ethene,分子式C2H4),碳碳之間有一雙鍵。
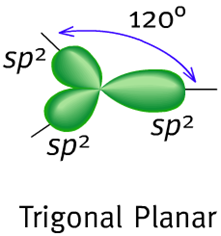
對於此分子來說,碳會以sp2的方式混成,因為碳碳之間必需有一個形成雙鍵的π(pi)鍵,而且一個碳只有三個σ鍵形成。在sp2的混成中2s軌域僅與2p 軌域中的兩個軌域進行混成:
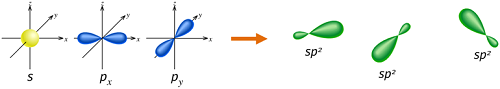
形成共三個sp2軌域而有一個p軌域留著。在乙烯中兩個碳原子間藉由兩個sp2軌域交疊形成一個σ鍵且每個碳原子也與氫原子藉由s–sp2的交疊形成兩個共價的σ鍵,鍵角均為120 °。而碳碳之間的π鍵是藉由2p–2p的交疊形成,且與分子平面垂直。所有碳-氫鍵的長度及強度都相等,亦與實驗結果相符。
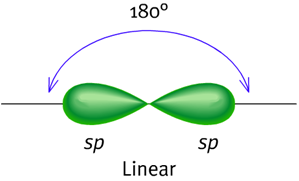
(3) sp 混成(sp hybrids)
化合物中像是炔類這種內含三鍵的一般都是以sp混成的方式。例如乙炔(ethyne,分子式C2H2),亦可與類似甲烷sp3混成的方式去解釋。
在這個模型中,2s軌域只會與三個p軌域的一個進行混成而形成兩個sp軌域,另外兩個p軌域則留著。乙炔中的化學鍵是含有碳-碳之間以sp–sp交疊而形成的σ鍵以及兩個以p–p交疊而形成的π鍵,還有碳-氫鍵中以s–sp交疊而形成的σ鍵,鍵角180°。
四、混成與分子形狀
混成(Hybridization)搭配價層電子對互斥理論(VSEPR Theory)可幫助我們解釋分子形狀。(A、X表不同原子,E表示孤對電子對)
(1) AX1 (e.g., LiH):無混成,一般都是直線形。
(2) AX2 (e.g., BeCl2):sp 混成,直線形或對角線形,鍵角∠XAX為180°。
(3) AX2E (e.g., GeF2):sp 混成,角形或V形,鍵角∠XAX小於 120°(孤對電子對效應)。
(4) AX3 (e.g., BCl3): sp2 混成,平面三角形,鍵角∠XAX為120°。
(5) AX4 (e.g., CCl4):sp3混成,正四面體形,鍵角∠XAX約為109.5°。
(6) AX3E (e.g.,NH3):sp3混成,三角錐形,鍵角∠XAX約為107°(孤對電子對效應)。
(7) AX5 (e.g., PCl5):sp3d混成,雙三角錐形。
(8) AX6 (e.g., SF6):sp3d2 混成,正八面體形或雙四角錐形。
參考文獻
(1) http://en.wikipedia.org/wiki/Hybrid_orbital
(2) http://www.mhhe.com/physsci/chem … y/flash/hybrv18.swf


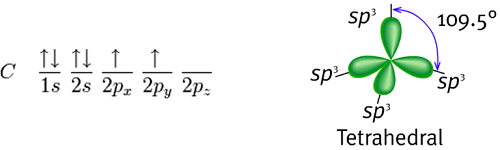

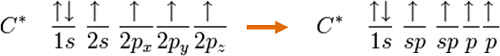

 前一篇文章
前一篇文章 下一篇文章
下一篇文章 利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  化學傳記:法拉第不為人知的一面(八):電解定律
化學傳記:法拉第不為人知的一面(八):電解定律  中間體與穩定狀態近似法
中間體與穩定狀態近似法  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 

老師您好:
剛剛發現到這個網站覺得很好,自己在讀化學的過程中遇到了瓶頸,不知道是否能在此提出疑問,希望能獲得指教
1.老師在文中提到在VSEPR的結構中提到AX2E是屬於SP混成軌域,可是在二氧化氮NO2分子中,也是AX2E,卻是屬於SP2混成,於是產生一個疑問。
2.對於二氧化氮分子(NO2),我們可以發現N原子左右各以一個單鍵與雙鍵與氧原子結合,然後保留一個自由基在身上,這邊希望向老師請教為什麼這個自由基會放在SP2的混成軌域中,而不是留在一個P軌域,不需要去混成?
3.基於上述的第2.題:
(1)我們發現如果C的鍵結方式剛開始為「= C < 」屬於左邊一對雙鍵、右邊兩個單鍵類似乙烯結構時,C混成是SP2。
(2)承上,若嘗試將C原子右邊取走一個H,此時C成為左邊一對雙鍵、右邊一單鍵、一對long pair這樣的c軌域混成依舊為sp2。
(3)最後,假設將右邊的long pair拆除,形成c左邊一對雙鍵、右邊維持一個單鍵,另一個為一個自由基C‧或是空軌域C⊕時,照前面的二氧化氮(NO2)的推理方式這樣的碳就會變成SP2混成,為角形結構。
事實上,在有機化學的反應中間體(Intermediate)卻發現這樣的C自由基(C‧)結構中,卻是屬於直線形的結構,這邊在軌域的混成卻為SP混成,與上面所述,想法上有所矛盾,想請教老師這邊該如何去解釋才不會有所迷思?
若文中想法上有所不周延請多多包涵,最近才跨入這個領域,邏輯上甚多不成熟的觀念,希望老師多見諒,也期待能獲得回應
造成不便,敬請見諒,謝謝
您好!
感謝您在高瞻平台上的發問,我們已將問題轉達給教授~
由於答案需要講解觀念,以及您的mail有問題,無法寄信給您!
因此要麻煩請您留下您的連絡電話
或是您可致電(02)77346119或是寫mail給教授~表達您的問題~
教授的聯絡訊息
「國立台灣師範大學化學系 葉名倉 教授
cheyeh@scc.ntnu.edu.tw」
非常感謝
如有任何問題歡迎隨時與我聯繫!!
高瞻計畫助理 陳怡安小姐
謝謝chenian07您的熱心幫忙,我已經將信件寄至教授於師大的信箱,個人的發問造成您的不便,跟您表示感謝與抱歉。
您好,我是上海复旦大学的学生,我们最近也学到了原子轨道理论,我发现我们好多用词都差别很大,比如你们所讲的混成轨域,我们习惯叫做杂化轨道,等等。很高兴看到有这么好的平台!
您好
關於混成軌域我有一個小問題
就是混成後電子的自旋態會改變嗎?
如果不會變那要如何配對才能符合庖立不相容原理
三.(2) sp2混成,乙烯的英文不是ethane,應該要改成ethene (ethane是乙烷)。
Dear p8410077 您好
您的提問經本站化學科責任編輯陳藹然博士回應如下:
「不應該說混成後電子的自旋態會改變,應該把原子軌域和分子軌域分開看。
當原子組成分子,利用軌域混成觀念得到分子中心原子的混成軌域,
之後才開始將電子庖立依不相容原理,將電子從低能量軌域往高能量軌域依序填入,
所以不存在自旋態改變一事。」
謝謝您的提問和耐心!
管理員teresa敬上
Dear Billy
謝謝您的細心指正!經責編確認後已修改!
非常感謝!
管理員teresa敬上
您好
看到您對混成軌域的解釋,再對照我上課用的講義,發現只有sp3混成的解釋和講義一樣,sp2混成在講義上則寫著:『把一個2s軌域提陞到2p軌域,然後一個2s軌域與2p軌域混成3個sp2混成軌域3個sp2混成軌域再各與2p軌域重疊』
另外,講義上寫的sp2的通式為AX3E0和AX2E1,都和這裡有些出入,是否是講義寫錯,或是解釋不同?
煩請多指教,謝謝~
建議應該提醒學生和高中老師,混成軌域本質上是一種解多體問題的近似方法,基本上原子的電子狀態不一定構成一個完備集以span出所有分子電子狀態。