週期表
[物理史] 莫斯利(Henry G. J. Moseley)在戰爭中陣亡了
莫斯利(Henry G. J. Moseley)在戰爭中陣亡了
國立臺灣大學物理學系 楊信男教授、蕭如珀
(譯自APS News,2012年8月)
世界各地學習科學的學生都很熟悉以化學元素的特性和原子序為基礎的現代週期表,不過,早期週期表的組織架構卻是鬆散許多;例如,1789 年,拉瓦節(Antoine Lavoisier)將他 33 種化學元素表分類為氣體、金屬、土和非金屬。但是化學家都期盼能有一個顯示更精確的分類架構。
1869 年,門得列夫(Dmitri Mendeleev)和他的前輩對我們現代的元素週期表提出一個更好的架構,他們將其按照原子質量排序。可是,這樣還是會引發他將有些元素如何在表上排列的爭議。例如,他基於元素的物理和化學特性,將原子序 27 和 28 分別給予金屬鈷和鎳,雖然鈷的原子質量稍重,嚴格來說應該排在鎳之後。那是他直覺的躍進:門得列夫是基於該兩種元素已知的化學和物理特性做了他的決定。
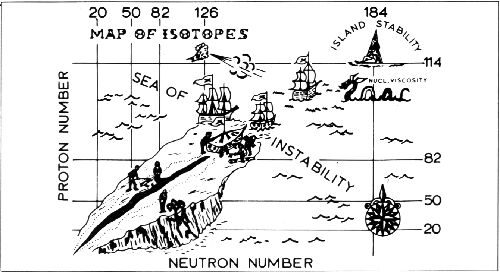
原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名
東京大學理學博士黃郁珊編譯/國立臺灣大學科學教育發展中心陳藹然博士責任編輯
在週期表裡,元素以原子序來排列,原子序代表原子核中的質子數目,具有相同質子數(但不同中子數)的原子有著同樣的化學性質,這些原子稱之為同位素。雖然同位素擁有相同的化性,因為原子核的穩定性不同也因此具有不同的生命長度。質子數低於或等於92的鈾為止都可以從自然界直接發現,比鈾更重的元素是透經由人工合成確認其存在。尤其是原子序104號以上,被稱為超重元素的元素,因為產量極少,難以僅透過化學性質的分析結果來證明新元素的合成,加上所有的超重元素都不安定,會在短時間內衰變為更安定的元素,因此要證明新元素的合成非常重要但又非常困難的一點就在於,確認該元素產生衰變鏈並轉變成已知的較輕原子核。
原子序
原子序 (atomic number)
國立臺灣大學物理系鍾豪
原子序 (atomic number) 是指原子核中質子的數量,因此又稱為質子數 (proton number),一般簡記為Z(Z是源於德文的Zahl,意思是「數字」),寫在元素符號的左下角。對於一顆電中性的原子而言,由於電子和質子數量相同,所以原子序大小也是電子的數量。
容易與原子序混淆的是質量數 (mass number) 和原子量 (atomic mass)。質量數是質子和中子數量的總合,一般簡記為A,寫在元素符號的右下角。因為電子質量極小(約是質子質量的1/1836),因此質量數可用來粗略表示該原子的質量。
莫色勒II(Henry Moseley II)
莫色勒II(Henry Moseley II)
高雄市立高雄高級中學化學科陳藝菁老師/國立中山大學化學系張祖辛副教授責任編輯
莫色勒證實稀土元素(rare earths),由鑭(lanthanum)至鎦(lutetium)剛好只有十五個元素。那時,鑭系元素的數目甚難確認,因為人們還不能提供所有稀土元素鹽類的純樣品;有時,也無法分辨出該樣品是純物質或是由兩個相似元素所組成的混合物;但莫色勒的儀器輕易地解決了這些問題。他也預測出61號元素的存在,當時的人從沒想過有這樣的元素。許多年以後,才由人造方法製出61號元素Pm。他也認為在Al至Au間已無其他未知元素存在。
莫色勒(Henry Moseley I)
莫色勒(Henry Moseley I)
高雄市立高雄高級中學化學科陳藝菁老師/國立中山大學化學系張祖辛副教授責任編輯
莫色勒是英國物理學家,生於1887年11月23日,死於1915年8月10日。他主要的科學貢獻為提出原子序(atomic number)和莫色勒定理(Moseley’s law)。他以較合邏輯的順序排列週期表(periodic table)上的元素,並提出原子核中的正電量與原子序相當。第一次世界大戰爆發後,莫色勒離開牛津大學去從軍,不幸於1915年在戰役中被狙擊手殺害,得年27歲。
化學性質的週期性(Periodicity of chemical properties)
化學性質的週期性(Periodicity of chemical properties)
高雄中學化學科 龔自敬老師/國立中山大學董騰元教授責任編輯
化學性質的週期性(Periodicity of chemical properties) 週期表的主要價值是可以根據各元素在週期表中的位置來預測其化學性質。值得注意的是, 沿著週期表的直行(族)移動和沿著水平(週期)移動,其性質變化是不相同的。在週期表中垂直的一欄元素稱為『族』(group);水平的一橫排稱為『列』(row)或『週期』(period)。『族』是元素分類中最重要的方法。某些『族』中的元素有非常相似的化學性質且存在著明顯的趨勢;這些『族』會被冠上非系統化(unsystematic)的別名,如:鹼金屬族(alkali metals)、鹼土金屬族(alkaline earth metals)、鹵素(halogens)、(noble gases)等;在週期表中另有些
- 1
- 2