化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔II〕
化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔II〕
國立彰化師範大學化學系碩士生陳少軍和陳永祥 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
觀察紀錄
一、 化學示範
1. 寫出此示範實驗的變化現象。
2. 說明變化現象的化學原理。
二、 過氧化氫的分解焓
A. 測定熱卡計的熱容量
● 熱水的體積:_____ mL,質量:_____ g
● 室溫水的體積:_____ mL,質量:_____ g
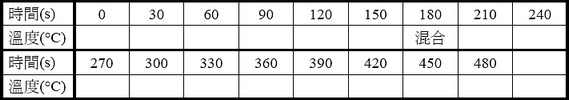
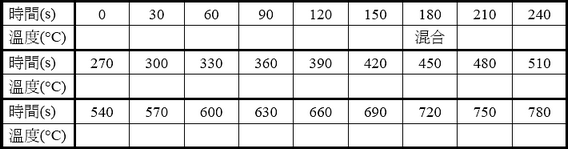
表一-A 熱水的時間與溫度之數據
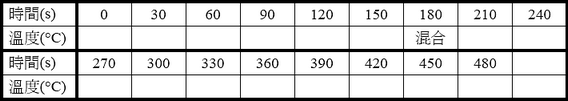 表一-B 室溫水的時間與溫度之數據
表一-B 室溫水的時間與溫度之數據

● 轉化表一-A和表一-B的實驗數據成為圖六,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖六上。
在混合時(tm)熱水的溫度(Tih):_____ ℃(由趨勢線的正推而得知)
在混合時(tm)室溫水的溫度(Tir):_____ ℃(由趨勢線的正推而得知)
在混合時(tm)溫水的溫度(Tf):_____ ℃(由趨勢線的倒推而得知)
在混合時(tm)熱水與溫水的溫度差(Tih – Tf):_____ ℃
在混合時(tm)室溫水與溫水的溫度差(Tf – Tir):_____ ℃
熱水所放出的熱量:_____ kJ
室溫水所吸收的熱量:_____ kJ
卡熱計放出的熱量:_____ kJ
卡熱計的熱容量:_____ kJ/℃
B. 測定二固體的溶解熱
● 碘化鉀的質量:_____ g,碳酸鈉的質量:_____ g
● 室溫水的體積:_____ mL,質量:_____ g
● 轉化表二的實驗數據成為圖七,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖七上。
在混合時(tm)室溫水的溫度(Ti):_____ ℃(由趨勢線的正推而得知)
在混合時(tm)溶液的溫度(Tf):_____ ℃(由趨勢線的倒推而得知)
在混合時(tm)室溫水與溶液的溫度差(Tf – Ti):_____ ℃
溶液總質量:_____ g
溶液所吸收的熱量:_____ kJ
卡熱計所吸收的熱量:_____ kJ
二固體的溶解熱:_____ kJ
C. 測定過氧化氫的分解熱和二固體的溶解熱
● 雙氧水的廠牌:_____ ,用途:_____ ,雙氧水的含量: _____
● 雙氧水的體積:_____ mL ,重量:_____ g
● 過氧化氫的莫耳質量:_____ g/mol(請到網路搜尋或向老師詢問)
● 過氧化氫的分解焓(文獻值):_____ kJ/mol(請到網路搜尋或向老師詢問)
● 碘化鉀的重量:_____ g,碳酸鈉的重量:_____ g
● 轉化表三的實驗數據成為圖八,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖八上。
在混合時(tm)雙氧水的溫度(Ti):_____ ℃(由趨勢線的正推而得知)
在混合時(tm)溶液的溫度(Tf):_____ ℃(由趨勢線的倒推而得知)
在混合時(tm)雙氧水與溶液的溫度差(Tf – Ti):_____ ℃
溶液總質量:_____ g
溶液所吸收的熱量:_____ kJ
卡熱計所吸收的熱量:_____ kJ
雙氧水的分解熱與二固體的溶解熱之和:_____ kJ
雙氧水的分解熱:_____ kJ
過氧化氫的莫耳數:_____ mol
過氧化氫的分解焓(測量值):_____ kJ/ mol
過氧化氫的分解焓(文獻值):_____ kJ/mol(請到網路搜尋或向老師詢問)
實驗誤差:_____ %
問題
1. 過氧化氫的分解,依照下列熱化學反應式:
H2O2(l) → H2O(l) + 1/2O2(g) △H = -98.1 kJ
當1.00 g的過氧化氫分解時,計算熱的變化量。
2. 根據你的實驗結果,一瓶400 mL的3.0%外用雙氧水分解後可放出多少kJ?
3. 本示範實驗的不鏽鋼水壺內,裝65 mL的30%過氧化氫,根據你的實驗結果,依比率類推,此過氧化氫分解後放出多少熱量?假設此過氧化氫視為純水,密度為1.00 g/mL,而且在室溫20 ℃下,請問有多少mL的水可以沸騰?已知水的比熱為4.18 kJ/℃‧g,水的汽化熱為2.26 kJ/g。
4. 過氧化氫是一種無色的液體,由於它分解產生氧氣,因此其溶液可作為漂白劑和防腐劑。已知液體水的標準形成焓為-285.8 kJ,過氧化氫的標準形成焓為-187.8 kJ。利用黑氏定理,請問過氧化氫分解成為液體水和氧氣的分解焓為多少?
5. 討論本實驗誤差的可能主要來源,並說明其理由。
連結:過氧化氫分解焓的測定〔III〕





 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  暖暖包的原理
暖暖包的原理 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法 
