熔點 (Melting Point)
熔點 (Melting Point)
國立台灣大學化學系陳光彥/國立臺灣大學化學系陳藹然博士責任編輯
固體的熔點是其從固態轉變成液態時的小範圍改變之溫度,一般約在1-2度間,固體和液體會在達到熔點時共存;反之,當液體從液態轉變成固態時的溫度稱為凝固點(freezing point)。熔點是純物質的物質特性之一。晶體又因類型不同而熔點也不同,一般來說晶體熔點從高到低為,原子晶體>離子晶體>金屬晶體>分子晶體。
對大部分的物質來說,熔點等於凝固點,例如水銀的熔點及凝固點都是234.32K (-38.83℃) ;但有些物質,其固液態互相轉換的溫度並不相同。舉例來說洋菜(agar)的熔點為85℃,卻在31℃~40℃之間凝固成固體。
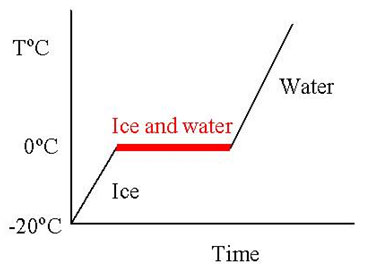
當固體受熱時會發生什麼樣的變化呢?一般來說固體會熔化變成液體,繼續加熱到某個程度液體會沸騰而變成氣體。這個過程可由溫度對加熱時間的關係圖表示(Heating Curve)。當熱能流入了冰裡,水分子的動能會隨著溫度的上升而增加,當水分子獲得的能量超過了某個程度之後,水分子會離開原本在晶格上的位置,不再緊密排列,而從固體變成了液體,這個過程可由下圖 0℃的紅色水平線表示表示。這個溫度也稱為水的熔點。在熔點時,所有加入的熱能將藉由破壞氫鍵來擾動冰的結構;將一物質從固態變成液態所需的熱量稱為熔化焓(Heat of Fusion)。
值得注意的是狀態的變化是物理現象,而不是化學現象,因為分子間的作用力雖然被破壞了,但沒有任何的化學鍵被打斷;如果把水蒸汽被加熱至更高的溫度,水分子的共價鍵可能會斷裂而變成獨立的原子,這個現象才叫做化學變化。
熔點常被用來鑑定有機及無機化合物並了解其純度,一個純物質的熔點一定比其不純物來的高。對於純物質,都有固定熔點,即在一定壓力下,部分熔化至全熔的溫度不超過0.5~1℃。但如混有雜質則其熔點下降,且熔點範圍也較大。因此我們可以藉著熔點的測定是來辨認物質的本性,也可瞭解一化合物的純度。
最後談談三個相近常被混用的詞,熔化、溶化與融化。「熔化」是物質從固態變成液態的過程,是一種物態變化的過程,此過程中需要加熱,所以用“熔”。如加熱冰熔化為水,蠟被加熱被熔化。而「溶化」指固體溶解,指某固態物質,在另一種液態物質中分散成單個分子或離子的擴散過程。此過程不需加熱,但必須有液體,所以用“溶”。如把糖放在水中溶化成為糖水等。物質的熔化必須通過加熱或對它做功,達到一定溫度後才進行,而溶化是在任何溫度下都能進行的,一般情況下,溶液的溫度越高,溶化就越快,溶化的物質也較多(氫氧化鈣Ca(OH)2等是例外)。最後,「融化」通常指抽象的事物。如春嬌的心被志明的愛融化了。你現在不會再被三個詞搞混了吧!
參考資料:
1. Melting point. http://en.wikipedia.org/wiki/Melting_point
2. Zumdahl, S.S. Chemistry, 6th Ed., 488-492.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法 
