氯化鈉
氯化鈉 (Sodium chloride)
國立臺灣師範大學化學系碩士班二年級江孟潔
氯化鈉的性質
氯化鈉為食鹽的主要成分,分子式為 $$\bf{NaCl}$$,為離子化合物,其外觀無色立方結晶或白色結晶,沸點 $$1413^\circ C$$,熔點 $$801^\circ C$$,密度 $$2.165~g/cm^{3}$$,用於製造純鹼和燒鹼及其他化工產品,食品工業和漁業用於鹽腌,還可用作調味料的原料和食用防腐劑。
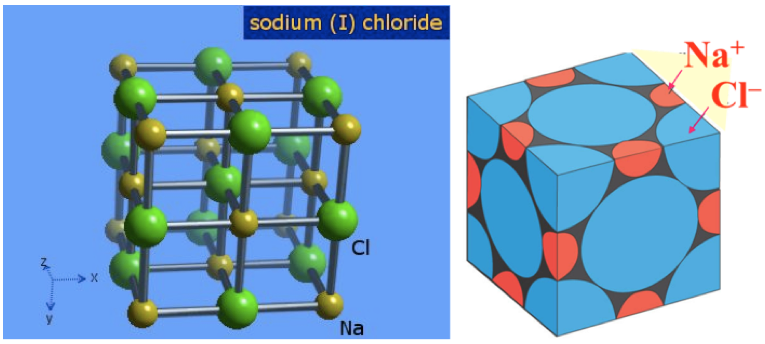
氯化鈉的晶體為立方對稱,晶體結構排列為每個 $$\bf{Na}^+$$ 離子最鄰近的 $$\bf{Cl}^-$$ 離子有 $$6$$ 個, 每一個$$\bf{Cl}^-$$ 離子最鄰近的 $$\bf{Na}^+$$ 離子也有 $$6$$ 個,此結構稱為面心立方晶體結構(face-centered cubic)
此單位晶格內含等數量 $$\bf{Na}^+$$ 及 $$\bf{Cl}^-$$。
製造方法
$$(1)$$ 將天然海水經由蒸發的方式(無法直接獲得高純度的氯化鈉)及結晶作用(獲取純淨固態氯化鈉)而得,也可以直接由地下或地表礦藏開採而得。
$$(2)$$ 切一小塊鈉塊,經過燃燒後,快速的丟進含有氯氣的瓶中,一瞬間發出亮黃色的光,進而產生白色氯化鈉。(注意:鈉金屬的活性很強)
$$2\bf{Na}+\bf{Cl}_2\longrightarrow 2\bf{NaCL}$$
$$(3)$$ 將等量的鹽酸與氫氧化鈉混合,會生成氯化鈉溶液。反應結束後再把溶液蒸餾移除,即可在實驗室終製備而得到氯化鈉的晶體。
用途
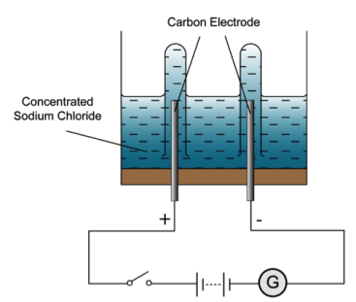
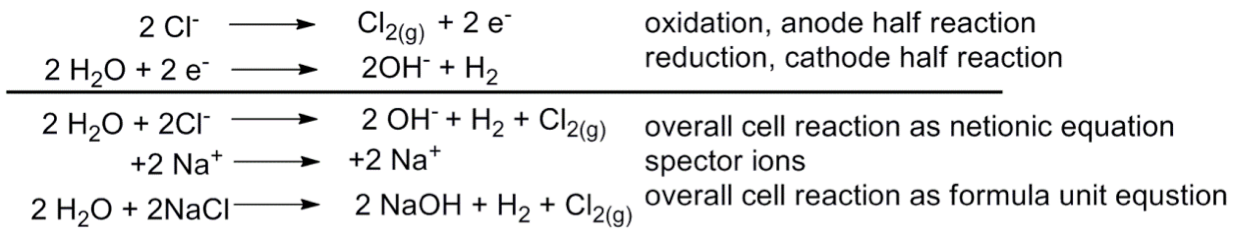
電解飽和食鹽水
在負極獲得電子,發生還原反應,形成中性物質而析出,電解池的負極是陰極。
同時溶液中的陰離子會在電解池的正極釋出電子,發生氧化反應,電解池的正極是陽極。
純鹼行業
透過氨鹼法 (Solvay process),可以將起始物氯化鈉和碳酸鈣進行反應,得到碳酸鈉及氯化鈣產物。
其中碳酸鈉在工業上的主要應用領域有用於製造平板玻璃、日用玻璃、合成洗衣粉、以及氧化鋁等行業中。
生理作用
一個適當的氯化鈉的攝入量對健康有許多好處。氯化鈉是一種相當重要的生理組成成分。所有的體液,包括血液都需要氯化鈉來作為電解質。血液中的鈉離子濃度也會影響神經傳導物質的信號,因此鹽經常被發現在健身飲料。電解質允許神經之間的電信號的傳輸。由於這項原因,氯化鈉同時也有助於幫助肌肉鬆弛。此外,它還有其他重要作用例如幫助細胞的養分吸收。雖然人體攝取氯化鈉非常重要,但攝取過多也會有導致高血壓的風險存在。
日常生活
在日常生活中,可用氯化鈉去除食物中的一些異味,同時增加其美味。除此之外,氯化鈉還能用來保存一些食物。更能用於傷口的消毒上,因此氯化鈉在我們生命中更是不可或缺的一種化合物。
參考資料
- Kenneth W. Whitten, Raymond E. Davis , Larry Peck, George G. Stanley , Chemistry(eighth edition) 第482~483頁,第795~796頁。
- V. Stick Robert, Mocerino Mauro, J. Chem. Educ., 1996, 73, 539
- 氯化鈉 http://en.wikipedia.org/wiki/Sodium_chloride


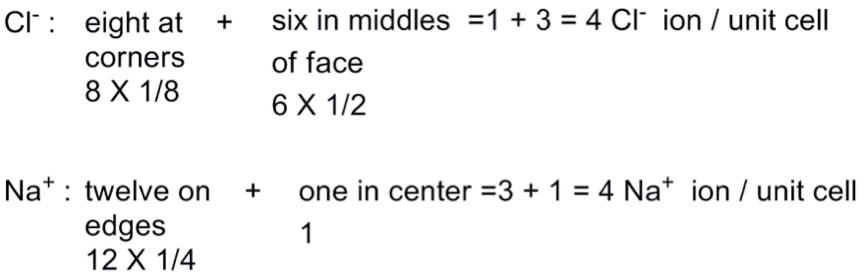
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體 
