葉綠素(Chlorophyll)
葉綠素(Chlorophyll)
國立臺灣師範大學附屬高級中學生李微/國立臺灣師範大學附屬高級中學化學科陳昭錦老師
葉綠素是地球上分布最廣的自然色素,目前已知其化學結構有超過一百種的變異存在。一片含有七千萬個細胞的葉子,擁有約五十億個葉綠體(chloroplast),其中每個葉綠體含有約六億個葉綠素分子。
葉綠素是一種綠色色素,存在於藍綠菌以及植物與藻類的葉綠體中,是一種重要的生物分子,因為在光合作用中,葉綠素扮演著非常重要的角色,使植物吸收光能並轉換成能量。葉綠素在電磁波光譜中的藍光波段有最強的吸收,其次是紅光波段,然而對綠光及鄰近波段的吸收很差,因此含葉綠素的組織呈現綠色。
葉綠素於 1818 年首先由 Caventou 與 Pelletier 從植物葉中分離出綠色物質,其名稱字源來自希臘文的「綠色」與「葉子」。
化學結構
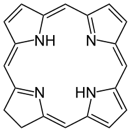
葉綠素是一種二氫卟吩(chlorin)類的色素(圖一),結構上類似紫質類的錯合物,如原血紅素。紫質類錯合物的中心金屬離子,可以是 $$\bf{Fe^{2+}}$$、$$\bf{Co}$$ 或是 $$\bf{Mg}$$,作為配位基的紫質,是一大分子雜環化合物,為平面結構的四牙基,是卟吩(porphin,$$\bf{C_{20}H_{14}N_4}$$)的衍生物,有取代基的卟吩即稱為紫質(圖二)。紫質環是一個高度共軛的體系,並因此顯現深色。葉綠素是由鎂離子為中心,與紫質配位形成的螯合物。
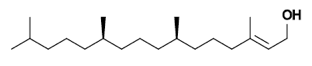
葉綠素於 1900 年代初期被發現時,是首次在生物組織中偵測到鎂元素的存在。二氫卟吩的環狀結構可以有數種不同的側鏈,通常含有一葉綠醇(phytol)長鏈(圖三)。用鹼水解葉綠素可得到葉綠醇,是一個親脂的脂肪鏈, 葉綠醇是合成維生素 K 及維生素 E 的前驅物。
自然界中的葉綠素有幾中不同的形式,廣泛分布於陸生植物中的是葉綠素a。
1905 年德國化學家 Willstatter 開始研究葉綠素,1906 年俄國植物學家 Tsvet 進行葉綠素研究時發明色層分析法(Chromatography),其後 Willstatter 利用此方法提取綠葉中的物質,經過十年的努力,他終於分離出綠葉中的神秘物質-葉綠素,進而證實在綠葉細胞中以三比一的量存在的葉綠素a 及 b,都是鎂的錯合物。他因此而獲得1915年諾貝爾化學獎。
1930 年德國有機化學家Fischer對血紅素及葉綠素的研究,及血紅素合成的貢獻,讓他獲得了諾貝爾化學獎。Fischer 主要研究綠色植物中葉綠素的色素、血液及膽汁中的色素。
在他的實驗研究中,他曾合成過許多的化合物,其中最重要的是在 1929 年,成功合成血紅素,並在 1930 年到 1940 年間,發表了上百篇和葉綠素(Chlorophyll)研究有關的論文,並且確定了葉綠素的結構。其中證明了葉綠素分子中含有二氫卟吩環系,且中心位置含有和二氫卟吩形成配位的鎂原子。他在葉綠素領域豐富的研究成果,為後來合成葉綠素的研究奠定了基礎。
到了 1960 年,有關葉綠素a 的立體化學研究已幾乎完備,Woodward 發表了葉綠素a 的全合成步驟。葉綠素幾種常見的結構如表一所示。
 |
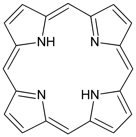 |
| 圖一 二氫卟吩(chlorin) 20πe- | 圖二 卟吩(Porphine)-最簡單的紫質(Porphyrin) 22πe- |
 |
|
圖三 葉綠醇 |
化學性質
存在植物葉綠體中的葉綠素主要有葉綠素a 和葉綠素b 兩種,難溶於水,可溶於有機溶劑,如乙醇、丙酮、乙醚、氯仿等。由於在結構上的差別,葉綠素a 呈藍綠色,而葉綠素b 呈黃綠色,在光照下易被氧化而褪色。
葉綠素可視為葉綠酸的酯,能與鹼進行皂化反應。葉綠酸是二元羧酸,其中一個羧基與甲醇發生酯化,另一個與葉綠醇酯化。葉綠醇是由四個異戊二烯單位組成的雙萜,是親脂的脂肪族鏈,它的存在決定了葉綠素分子的脂溶性,使之溶於有機溶劑中。
葉綠素的化性不是很穩定,光、酸、鹼、氧、氧化劑等都會使其分解。
葉綠素紫質環中的鎂離子可被氫離子、銅離子、鋅離子所置換。酸性條件下,葉綠素分子很容易失去紫質環中的鎂成為去鎂葉綠素。用酸處理過的葉片,氫離子易進入葉綠體,置換鎂形成去鎂葉綠素,使葉片呈褐色。去鎂葉綠素易再與銅離子結合,形成銅代葉綠素,顏色比原來更穩定。人們常根據這一原理用醋酸銅處理來保存綠色植物標本。葉綠素溶液能進行部分類似光合作用的反應,在照光下使某些化合物氧化或還原。人工製備的葉綠素膜在照光下能產生光電位和光電流,也能催化某些氧化還原反應。
葉綠素與光合作用
葉綠素是自然界中最重的螯合物,它能藉由光合作用將太陽光轉變為化學能。在光合作用中,葉綠素吸收的能量能使二氧化碳和水轉變為葡萄糖與氧氣,如方程式 $$(1)$$ 所示:
$$\mathrm{6CO_2+6H_2O\overset{h\nu}{\rightarrow} C_6H_{12}O_6+6O_2~~~~~~~~~(1)}$$
表一 數種常見的葉綠素分子及結構
|
葉綠素a |
葉綠素b |
葉綠素d |
 |
 |
 |
| C55H72O5N4Mg | C55H70O6N4Mg | C54H70O6N4Mg |
| 普遍存在 | 存在於大多數植物中 | 存在於藍綠菌中 |
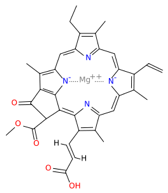
| 葉綠素c1 | 葉綠素c2 |
 |
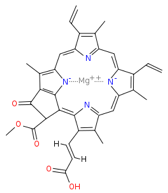 |
| C35H30O5N4Mg | C35H28O5N4Mg |
| 存在於各種藻類中 | 存在於各種藻類中 |
透過光合作用儲存在碳水化合物中的化學能,可驅動大多數所有生物有機體中的生化反應。在光合作用中,二氧化碳被水還原,意即電子從水被轉移到二氧化碳,葉綠素協助此電子轉移過程。當葉綠素吸收了光能,其上的電子受到激發,處在激發態的電子更容易轉移到另一分子,這啟動了連鎖的電子轉移步驟,最終電子轉移到二氧化碳上。
同時,失去電子的葉綠素從其他分子中獲得電子,這就是水分子失去電子引發的最終結果。因此,葉綠素是光合作用中二氧化碳與水發生氧化還原反應的關鍵。
參考資料
- 色層分析(Chromatography)。http://highscope.ch.ntu.edu.tw/wordpress/?p=3268
- 化學傳記:1930年諾貝爾化學獎得主-漢斯費歇爾 (Hans Fischer)。 http://highscope.ch.ntu.edu.tw/wordpress/?p=26393
- Chlorophyll。檢索日期2013/08/13。http://en.wikipedia.org/wiki/Chlorophyll
- Chlorophyll。檢索日期2013/08/16。http://www.scifun.org/chemweek/CHLRPHYL/Chlrphyl.html


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義 
