氧化還原反應
氧化還原反應 (Redox Reaction)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
拉瓦節 (Lavoisier)是最早提出氧化概念的化學家。在1777年出版的《燃燒概論》和1778年出版的《酸性概論》著作中,他正式闡釋了自己的氧化說。他認為燃燒是物質和空氣中的氧氣反應的結果,同時基於很多燃燒產物的水溶液具有酸性,他得出任何酸中都含有氧的錯誤結論。所以1779年他將空氣中幫助燃燒的一部分命名為oxygen(希臘語:形成酸的)即氧氣,另一部分命名為azote(希臘語:無生命的)即氮氣。
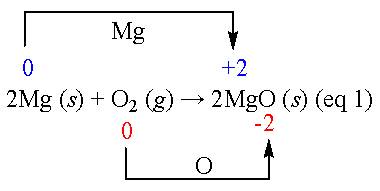
我們一般認為,物質與氧的結合反應稱作氧化;反之,若從物質移出氧的反應稱為還原,這是傳統的氧化還原反應概念。以鎂在空氣中燃燒為例,就是金屬鎂被氧化。
2Mg + O2 → 2MgO (eq 1)
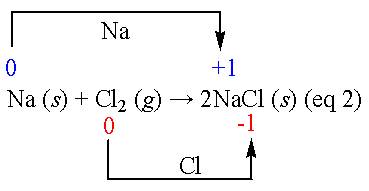
但隨著科學不斷進步演變,氧化還原反應的定義現在已被視為電子轉移 (electron transfer)的行為。因此,在廣義的描述上,氧化(oxidation)是指一個分子、原子或離子,因電子的失去或氧的獲得而造成其本身的氧化態 (oxidation state)的升高;反之,若因電子的獲得或氧的失去而造成其本身氧化態的降低,稱作還原。例如,金屬鈉與氯氣反應,鈉金屬因失去一個電子而被氧化成鈉離子;氯因得到一個電子而被還原成負一價的氯離子。
同理,上述的金屬鎂被氧化反應(eq 1)也可依此概念來說明氧化還原的概念。
然而,並不是所有的氧化還原反應都是如前例,電子在物質間進行完全轉移的行為。因此,有時氧化還原反應該以氧化數 (oxidation number)的改變之概念來描述會比較適當且容易理解。氧化數是依物質中元素對電子吸引強弱分配後而定義的數值,用來表示物質在反應中得失電子的程度。
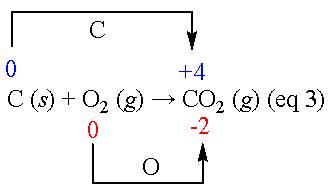
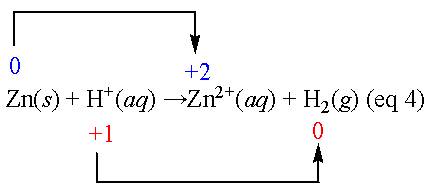
當物質進行氧化還原反應時,A物質失去電子而氧化數增加就是氧化,另一物質B同時也會因得到電子使其氧化數減少,這就是還原。例如焦碳 (C)與氧(O2)完全燃燒反應,生成二氧化碳(CO2)的反應(eq 3)。碳原子的氧化數從原本的0價增加到+4價,而氧原子則從0價減少到-2價。另外,金屬與稀酸作用而產生氫氣的反應(eq 4),鋅的氧化數從0價增加成+2價(氧化),氫從正一價減少0價(還原)。
氧化還原反應不是只有發生在實驗室,在我們身上和我們所處的環境中,氧化還原反應不斷的發生。只有了解氧化還原反應,才能窺視自然奧祕的核心。
參考資料
1. Redox. http://en.wikipedia.org/wiki/Redox_reaction
2. Antoine Lavoisier. http://en.wikipedia.org/wiki/Lavoisier


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  暖暖包的原理
暖暖包的原理  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體 
