細胞內的碎紙機-蛋白酶體(Proteasome)
細胞內的碎紙機-蛋白酶體(Proteasome)
台北市立第一女子中學生物科胡苓芝老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
蛋白酶體(proteasome)存於真核細胞的細胞核和細胞質中,為溶體(lysosome)外的蛋白水解構造,是細胞調控特定數量蛋白質和除去錯誤摺疊蛋白質的場所。人體每個細胞的細胞核與細胞質中,約含有三萬個蛋白酶體。
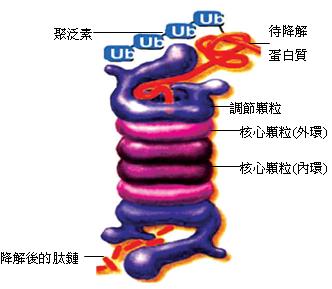
從結構上看,蛋白酶體包括核心顆粒和調節顆粒二部份,均由蛋白質組成(圖1)。核心顆粒是由多種不同的蛋白質組裝成的中空桶狀複合物,這些蛋白質堆疊成四個環,外側兩環可以發揮「門」的作用,門上的調節顆粒,可以識別連接在蛋白質上的聚泛素(polyubiquitin)標籤,並啟動降解過程,一方面去除泛素,並將泛素釋回細胞質中重複利用;一方面利用水解ATP,釋出能量破壞蛋白質的二三四級結構,並將此解旋後的線型蛋白質注入中空部位。中間兩環內側具蛋白酶活性部位,為切割蛋白質的場所,降解出來的肽鏈由蛋白酶體的另外一端釋放出來。這樣的構造能避免細胞質中的蛋白質誤觸蛋白酶體的活性位置,造成不當的分解。
人體蛋白酶體中的蛋白酶活性主要為類胰凝乳蛋白酶(chymotrypsin)型、類胰蛋白酶(trypsin)型和肽-麩胺醯基-水解酶(peptidyl-glutamyl peptide-hydrolyzing)型三種。它們能在蛋白質的多肽鏈中,選擇性地從酪胺酸、色胺酸、苯丙胺酸、麩胺酸、天冬胺酸、精胺酸或離胺酸等多種胺基酸的羧基側進行水解,切斷肽鏈。經過蛋白酶體的降解後,蛋白質一般被切割為約7-9個胺基酸長度的肽鏈;這些肽鏈可進一步被分解為單一胺基酸分子,用於合成新的蛋白質。
有些降解後的肽鏈會在專一性免疫系統運作中扮演著關鍵角色,例如當病毒感染細胞後,屬於病毒的肽鏈抗原會由第一型主要組織相容性複合物(MHC I)呈現於細胞表面,引發細胞免疫。這些肽鏈就是來自感染細胞中入侵的病原體經蛋白酶體降解後的產物。此過程主要是由γ干擾素所誘導,產生一種特殊的調節顆粒參與的作用,可以有效地生成大小和成分均適合的降解片斷以供MHC結合。
蛋白酶體僅是執行蛋白質分解的角色,它不能決定那些蛋白質應該銷毀,決定哪一些蛋白質需要貼上銷毀的標籤,是泛素連接酶的工作。這種包括泛素化和蛋白酶體降解的整個系統被稱為「泛素-蛋白酶體系統」(ubiquitin-proteasome system; UPS)。
【參考資料】
諾貝爾獎網站有關蛋白酶體的動畫
http://nobelprize.org/nobel_prizes/chemistry/laureates/2004/animation.html


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 白蟻透過腸道微生物高效率獲得能量
白蟻透過腸道微生物高效率獲得能量  【2014諾貝爾生醫獎】發現大腦裡空間記憶的構築細胞
【2014諾貝爾生醫獎】發現大腦裡空間記憶的構築細胞  近視可能與基因有關
近視可能與基因有關  共軛焦顯微鏡的使用原理
共軛焦顯微鏡的使用原理  戀愛活化大腦多巴胺神經
戀愛活化大腦多巴胺神經  【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)
【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)  伊波拉病毒(I)-與死亡共舞
伊波拉病毒(I)-與死亡共舞  伊波拉病毒(II)-「無知與不信任」才是真正的敵人
伊波拉病毒(II)-「無知與不信任」才是真正的敵人 
