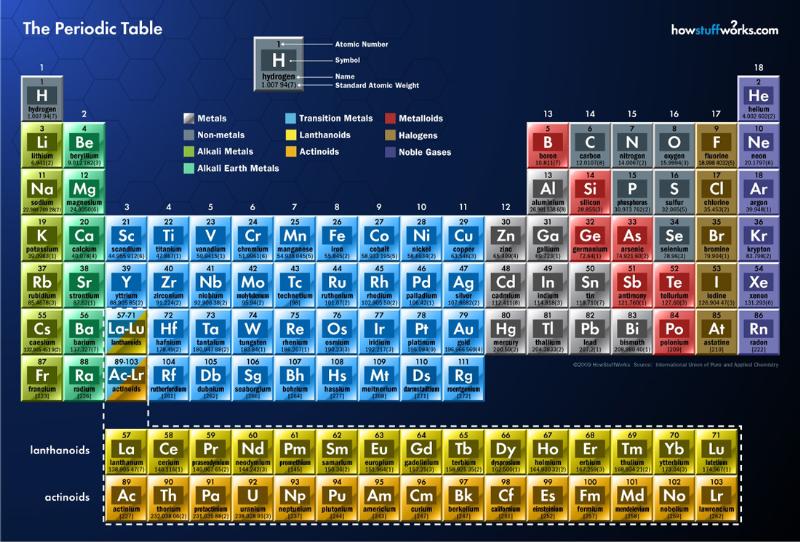
元素
週期表、原子序、鹼金屬、鹼土金屬、鹵素、惰性氣體、主族元素、過渡元素、放射元素、生物物質
同位素發現百年紀念
同位素發現百年紀念
國立臺灣大學科學教育發展中心特約編譯郭冠廷

REFLECTION
Soddy in his lab at the University of Glasgow.
Credit: University of Glasgow Archive Services, GB0248 UP1/503/1
Frederick Soddy在一百年前的這個月發現:元素可以有幾種原子量。
1913年的12月4日,輻射化學家Frederick Soddy(弗雷德里克·索迪,1877年9月2日-1956年9月22日)提出「同位素」的概念。而Soddy也因此獲得1921年諾貝爾獎的殊榮。
一位早熟的少年
Soddy出生在1877年9月2日英國的Eastbourne,他是一位早熟的少年。在18個月大時,就面臨母親的去世,由信仰加爾文傳統(Calvinist tradition)[1]的堂妹扶養長大,也因此培養出索迪獨立於當代社會與宗教的獨立性思考模式。Soddy曾在Eastbourne學院、Aberystwyth學院Wales分院、Merton學院、Oxford大學就讀。而後於1898到1900之間,在Oxford大學進行獨立研究。
放射性蛻變的發現
1900年Soddy在McGill大學時,成為一名化學界的示威者。與英國物理學家Rutherford共同研究物質的放射性。而在當時,對放射性的瞭解可說是少之又少,而Soddy與Rutherford就已經意識到,放射性的存在,是肇因於元素的衰變。元素衰變時會釋放α-, β-, and γ-radiation。Soddy用化學方法來辨別出衰變的產物。並於1900到1902年之間的時8個月當中,Soddy和Rutherford共同出版了九篇歷史性的文章,文章當中提出了:原子分裂後可以產新的物質。而這正是古代煉金術師們的夢想,因此Soddy稱這個過程為煉金用語中的「蛻變(transmutation)」。
Rutherford和Soddy的放射性理論,解釋了蛻變的發生。他們是首位計算出放射性蛻變的過程中,會伴隨大量能量釋放過程的學者。可惜的是,Soddy因為被誤認為僅是Rutherford底下的年輕助手,而非工作伙伴。因而在這項發現當中,Rutherford獲得大部分的榮耀,而Soddy也因此與1908年的諾貝爾化學講擦身而過。
兩位學者共同提出放射線的存在,並從Uranium-92和Thorium-90出發。這兩個元素的最終產物都是Lead-82。因此兩位學者主張,Helium應該是Radium-88的衰變產物。
惰性氣體的應用
惰性氣體的應用(Noble Gas Applications)
國立臺灣師範大學化學系黃鈺雅研究生
惰性氣體,又稱稀有氣體、貴氣體、或是鈍氣,正好為週期表第18(8A)族元素,包含有氦(He)、氖(Ne)、氬(Ar)、氪(Kr)、氙(Xe)、氡(Rn)。是一組具有類似性質的化學元素,在標準條件下,它們都是無色、無味、有非常低化學反應性的單原子氣體,而為什麼它們的化學反應性較低且可以單原子的方式存在呢?其原因主要可用原子軌域理論來解釋,惰性氣體最外層電子排列為全滿的狀態,當電子組態在全滿的狀況下最為安定,因此惰性氣體的化學反應性較低,而且可以單原子的方式存在,不類於其它氣體(例如:氧氣O2、氫氣H2等…)無法以單原子方式存在。以下分別針對各個惰性氣體之應用做初步介紹:
氦(He,1s2):
氦是最輕的惰性氣體,此氣體不自燃且不助燃,因此常用於冶煉和焊接時的保護氣體,亦可用來填充燈泡和霓虹燈管,還有填充氣球等…此外氦氣在人體血液中之溶解度較低,對於長時間需潛入深海之潛水人員而言,氦氣可填入他們的氧氣瓶,以防止潛水夫病。當氦在液態狀況下,其溫度接近絕對零度,故於超導研究中作為超流體之應用,還常用做化學儀器的冷卻劑和製冷劑。
氖(Ne,1s22s22p6)
氖因可發出橘紅色亮光,因此日常生活中,此氣體普遍做為霓虹燈或照明用之指示燈所用;此外,氖氣亦常與氦氣結合,作為氣體雷射(gas lasers),即俗稱之氦氖雷射,雖然單獨的氖氣也可激發雷射光,但氦氖結合後所發出的雷射光的強度高於只有氖時的200倍;而其結構主要係將氦、氖氣體混合放置於同一放電管內,以增強共振腔內之強度。氦氖雷射是屬於低能量雷射,近幾年被皮膚科拿來應用,是溫和且有效的治療方式。
氬(Ar,1s22s22p63s23p6)
氬則是最早被發現且佔空氣含量最高之惰性氣體,亦由於其含量較多之緣故,常作為避免較活潑且易發生化學反應之物質,產生反應作用。例如:在釀酒封裝之過程中,填入氦氣避免酒受氧化而加速酸化。另外,氬氣的導熱率較低,故也常作為隔熱填充材。
鑭系元素──鈰及其化合物(Lanthanides, Cerium)
鑭系元素──鈰及其化合物(Lanthanides, Cerium)
臺北市立第一女子高級中學二年級吳宛臻
屬性:
類金屬 ( Metalloids )
類金屬 ( Metalloids )
國立臺灣師範大學化學系碩士班二年級陳筱鳳研究生
類金屬 ( metalloids ) 是一個用來分類化學元素的名詞。根據它們的物理及化學特性,元素週期表上的化學元素大都可被分類為金屬或非金屬;但有一些元素的性質介於金屬和非金屬之間,僅具有部分金屬或非金屬的性質,即稱為類金屬。[1]
類金屬又稱為準金屬或半金屬。但由於缺少正常金屬的延展性,所以只能算是 ” 半 ” 金屬。分別為硼 ( B ) 、矽 ( Si ) 、鍺 ( Ge ) 、砷 ( As ) 、銻 ( Sb ) 、碲 ( Te ) 這六種元素,而有時釙 ( Po ) 和砈 ( At ) 也被視為類金屬。這類元素的外電子層構型為ns2np 1~5 。在週期表中呈階梯狀的排列,特別的是,這些類金屬元素即使屬於不同族群,也可能會擁有相似的性質。[2]
鈾
鈾 (Uranium)
臺北市立第一女子高級中學二年級陳亭均
簡介
鈾是元素週期表中錒系的金屬元素,原子序數為92,元素符號是U。鈾在地球上形成各式各樣的化合物,為許多礦物的構成元素之一,已知的含鈾礦物即超過150種。鈾存在於礦石、土壤以及水中,可藉開採含鈾礦物而提煉獲得。鈾元素於1789年被德國化學家馬丁•克拉普羅特(Martin Heinrich Klaproth)首先發現。鈾之英文名稱 Uranus 沿自天王星,而天王星名字來自希臘神祇烏拉諾斯。
鈾原子有92個質子和92個電子,其中6個是價電子。它的中子數目介於141至146個之間,共有六個同位素。自然界的鈾礦主要含有兩種鈾的同位素,即「鈾–235」(U235,比例約占0.7%)與「鈾–238」(U238,比例約占99.3%),其中鈾–235才能產生分裂反應,而鈾–238並不能產生分裂反應。所有鈾同位素皆不穩定,具有微弱放射性。鈾是自然元素中質量次重、原子量次高的元素,僅次於鈽-244。它的密度比鉛高出約70%,但不如金、鎢密實。鈾在自然界中以數百萬分率的低含量存在於土壤、礦石和水中,可藉由開採瀝青鈾礦等含鈾礦物並提煉之。
銣(Rubidium)
銣(Rubidium)
臺北市立第一女子高級中學二年級洪子晴
銣為1861年德國科學家羅伯特‧威廉‧本生(Robert Wilhelm Bunsen)以及古斯塔夫‧羅伯特‧基爾霍夫(Gustav Robert Kirchhoff)利用分光鏡進行光譜分析實驗時所發現之元素。本生在銣的光譜中看見極明顯的兩道紅光,故以此現象將其命名為rubidium,這個字源自拉丁文rubidus,意思是深紅色。
銣的化學符號是Rb,原子序數是37,分子量為85.46,熔點為38.89℃,沸點則為688℃。銣屬於鹼金屬的一種,外表為銀白色蠟狀固體,通常以化合物的形態存在於鋰雲母、銫榴石和光鹵石等礦物中。而在鋰雲母提取鋰後所剩的鹼金屬碳酸鹽混合物中亦能得到少量銣。
銫(Caesium,Cesium)
銫(Caesium,Cesium)
臺北市立第一女子高級中學二年級吳欣韋
銫(Caesium,Cesium)之發現
在1860年代,羅伯特‧本生(Robert Bunsen)與古斯塔布‧基爾西霍夫(Gustav Kichhoff)兩位德國科學家發明了一種分光器,它能將金屬的焰色反應的光,依波長來作區分;正當他們在測試礦泉水的焰色反應時,赫然發現了一種藍色波段,十分接近已知的藍色波長,所以經過一連串的分析與實驗,他們確定這種元素屬於鹼金屬,並且依光譜的顏色(藍色),將它命名為「銫(Caesium,Cesium)」,意指拉丁文的「藍天」。
銫(Caesium,Cesium)之簡介
銫的原子序是55,元素簡稱為「Cs」,隸屬於鹼金屬,位於周期表中的第一族之第6週期;基本的性質有:原子量為132.90545,其電子排列為2,8,18,18,8,1(6s1),晶體結構為體心立方晶格,原子半徑為265pm熔點為28.4度C,十分接近室溫,沸點為678.4度C,密度為1873公斤/立方公尺,常溫常壓下為淡灰色的固態金屬,主要存在於地表的銫榴石及鋰雲母中;而銫是一種非常柔軟的金屬,為所有元素中莫氏硬度最低的;由於銫的化學性質非常活潑,在空中也會自行氧化,所以必須貯存於惰性氣體中,若接觸到氫或水,會有爆炸性的反應,故被列為危險物品;在化合物中,銫通常是以+1價無色離子存在,其化合物除了複鹽之外,大都可溶解於水中,而少數的鹼化物與低氧化物的價數並不屬於+1;化合物中,其中氫氧化銫(CsOH)為一種具有強吸水性的強鹼,它能腐蝕矽等半導體材料的表面。而銫的製備通常有兩種方法:一種是電解法,一種是熱還原法,而因為銫有腐蝕性,所以較不適合電解法(易腐蝕電極),故工業上都用其他方法。
主族元素(Main Group Elements)
主族元素(Main Group Elements)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
主族元素,是指在元素週期表當中,s區(s-block)與p區(p-block)的元素。若用IUPAC對於元素的族的命名,則分別是1、2、13、14、15、16、17、18一共八個族的元素。在傳統對於族的CAS命名裡面,則分別是IA至VIIIA族元素。
12族的鋅、鎘、汞等元素,雖然說一般會併入d區的過渡金屬討論,然而其s與d軌域均填滿,因而具有一部份的主族元素性質,因此也有一些人主張,將12族元素算入主族元素。
主族元素佔據了宇宙,以及自然界、 生命體當中大部分的重要角色。組成生物體主要成分的碳、氫、氧、氮、磷、硫等,均是屬於主族元素當中的非金屬元素。主族元素除了氫以外,依照其性質,又有 鹼金屬、鹼土金屬、類金屬、半金屬、非金屬、鹵素、惰性氣體等分類。其中鹼金屬、鹼土金屬分別佔據了第1族與第2族,但不包含氫;而鹵素與惰性氣體則對應 了第17族與第18族。中間的13、14、15、16族,則較少有習慣稱呼;一般以硼族、碳族、氮族(pnictogen)、氧族(chalcogen) 等來表示。
鹼土金屬
鹼土金屬 (Alkaline Earth Metals)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
「鹼土金屬 (Alkaline Earth Metals)」是元素週期表當中,第2族 (Group 2 Elements)元素的總稱。鹼土金屬包含了鈹 (Be, Beryllium)、鎂 (Mg, Magnesium)、鈣 (Ca, Calcium)、鍶 (Sr, Strontium)、鋇 (Ba, Barium)和鐳 (Ra, Radium)六種元素,其中鈣、鍶、鋇三種又被稱為典型的鹼土元素。這六種元素皆存在於自然界,其中鐳為放射性元素,最穩定鐳同位素 226Ra半衰期約為一千六百年。