可能廣泛治療類澱粉蛋白沉積(amyloidosis)引起之神經性疾病的「萬用藥物」
可能廣泛治療類澱粉蛋白沉積(amyloidosis)引起之神經性疾病的「萬用藥物」
國立臺灣師範大學生命科學系李冠群副教授
類澱粉蛋白(amyloids ) 是一種不可溶的纖維狀蛋白質,名稱的由來是因為早期碘染色(iodine-staining)技術尚不成熟,使得科學家誤以為它是一種澱粉(拉丁文為amylum)。當時科學界一直在爭論它到底是屬於脂肪沈澱物,或是碳水化合物沈澱物,直到最後,才發現它其實是一種蛋白質。當類澱粉蛋白不正常地在器官中堆積時,會造成類澱粉沉積症(amyloidosis)。目前已知在人體內至少有18種蛋白質,會因為其蛋白結構錯誤折疊,導致與本身或與細胞內其他蛋白質發生糾結,形成纖維狀的類澱粉蛋白沉積。在阿茲海默症(AD)和帕金森氏症等多種神經性疾病患者的神經系統中,都可以觀察到大量類澱粉蛋白的沉積,因此,許多學者相信它可能是導致腦部或其他器官功能退化或功能障礙的原因。
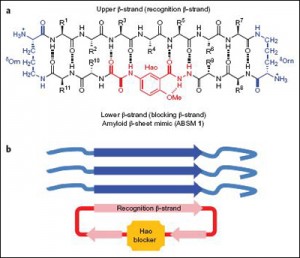
美國加州大學歐文分校的詹姆斯諾維克教授(James Nowick of the University of California, Irvine)和洛杉磯分校的大衛艾森伯格教授(David Eisenberg of the University of California, Los Angeles)所領導的研究團隊,已經共同研製出一種環狀胜肽類的模板分子,它可誘導多種胜肽形成β-褶板結構(β-sheet structures)。在體外的試驗中,這些β-褶板結構可以阻斷包括amyloid-β (簡稱Aβ)、tau和α-synuclein等多種蛋白的沉積,也可減少Aβ在細胞造成的毒性,而Aβ與tau正是阿茲海默症的致病蛋白質;α-synuclein則是帕金森氏症的致病蛋白質,因此,該種新型蛋白沉積抑制劑,在同時治療多種神經性疾病上具有極大的潛力。此結果已發表在2012年9月線上的《自然化學》(Nature Chemistry)期刊。
2000年,諾維克的研究團隊合成出帶有一種稱為“Hao”的人造氨基酸的環狀胜肽,發現每兩個這種胜肽會自行形成β-褶板的結構(dimer),但不會進一步形成聚集沉積。由於在阿茲海默症患者和前額葉癡呆(frontotemporal dementia)患者等的腦內,tau蛋白會形成β-褶板結構,並會進一步形成聚集沉積,造成神經纖維纏結(neurofibrillary tangles),於是科學家們嘗試納入tau蛋白片段,結果發現這種環狀分子會抑制tau蛋白衍生片段的聚集。然而,若將此法應用於Aβ蛋白,則阻止聚集的效果很微弱,這可能是因為含有Aβ蛋白片段的環狀分子太小之故。2012年,Nowick實驗室的博士班研究生Pin-Nan Cheng(來自台灣的鄭彬南,也是該篇研究論文的第一作者)和艾森伯格研究團隊的成員,以含有“Hao”的環狀胜肽為模板,創造出新型較大的環狀分子,該分子同樣能形成β-褶板構造,並可有效防止Aβ聚集,以及降低類澱粉蛋白聚集體的毒性。該團隊甚至將此環狀分子模板納入其他會導致類澱粉沉積症(amyloidosis) 的蛋白片段,例如tau、α-synuclein、第二型糖尿病有關的胰島類澱粉蛋白等,發現也有抑制聚集的效用(參見下圖)。
目前Nowick研究團隊只在生物體外測試了這些新型阻斷劑,他們對這些阻斷劑如何彼此作用、如何和正在聚集的蛋白質作用,以及蛋白質如何形成寡聚體(oligomers)深感興趣,最終將會把類似的阻斷劑分子引到模式動物中進行測試。此研究對於尋找更普遍阻斷不同蛋白聚集的新型阻斷劑而言,是邁出了一大步。
至於這類阻斷劑分子是否能成為阻止蛋白聚集的良好藥物,仍有待觀察。過去,曾有研究人員進行臨床試驗,測試某些Aβ聚集阻斷劑的效果,結果效用不大,例如Scyllo-inositol (又名 ELND005)是一種可阻止Aβ聚集的植物性糖醇,它能控制阿茲海默症轉基因小鼠的認知能力下降,但在第2階段人體臨床試驗中,對於輕度至中度阿茲海默症患者來說,並沒有提高這些患者的認知功能。另一種Aβ聚集抑製劑-Alzhemed(又名tramiprosate),雖然通過第2階段的臨床試驗,但在第3階段的阿茲海默症試驗中,並未出現臨床療效。
(本文由國科會補助「新媒體科普傳播實作計畫」執行團隊撰稿)
原文首刊載於國科會科技大觀園科技新知