超臨界二氧化碳 (Supercritical carbon dioxide)
臺北市立第一女子高級中學二年級陳郁欣/臺北市立第一女子高級中學化學科許名智老師
超臨界流體簡介
物質通常具有大家所熟知的固、液、氣三相,但當溫度及壓力都大於其臨界溫度及臨界壓力時,液體和氣體之間沒有明顯的界面,形成既非氣相也非液相的另一種均勻相,稱為超臨界相。
一般而言,超臨界流體具有低黏度、高密度、高擴散性和低表面張力等介於氣、液相之間的物理性質。例如,因為黏度接近氣體且擴散係數比液體高10至100倍,在輸送上較液體容易也迅速。密度接近於液體,因此可輸送比氣體更多的超臨界流體。此外,因為幾乎沒有表面張力,使之容易滲入多孔性組織中。在化學性質上,超臨界流體也與氣、液態時有所不同。例如,二氧化碳在氣體狀態下不具萃取能力,但進入超臨界狀態後,二氧化碳變成親有機性,因此產生隨溫度及壓力而不同的溶解有機物的能力。
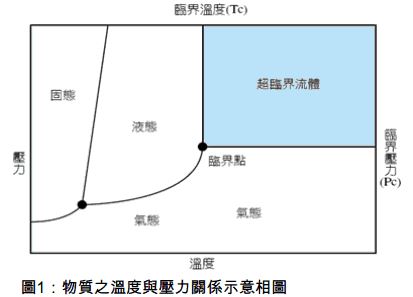
圖片來源:楊顯整(2009),「超臨界綠色技術之概述」,綠基會通訊,第7頁。
超臨界二氧化碳
目前超臨界流體技術的應用範圍包括萃取、分離、清洗、染色、純化、奈米顆粒形成與化學反應等。
超臨界二氧化碳具無毒、無色、無臭、費用低、無殘留、不可燃性、無廢水處理問題、化學穩定性佳及易達到臨界點(Pc=72.8 atm, Tc=31.1 ℃)等優點,是一種「乾淨」的溶劑,因此最常被使用。
(1) 去除咖啡中的咖啡因
先利用乾燥的超臨界二氧化碳,萃取經焙炒過的咖啡豆中的香味成分,再利用含有水分的超臨界二氧化碳,將咖啡豆中的咖啡因取出,最後將先前萃取出的咖啡香味放回不含咖啡因的咖啡豆中。由以上步驟可以發現,超臨界二氧化碳因為有高滲透力與低表面張力,而可深入咖啡豆內部。另外,因此也顯示我們可以藉由改變二氧化碳的物理及化學性質,來改變其溶解能力及對溶質的選擇性。

