沸點上升法求分子量的限制(上)
國立臺灣師範大學化學系兼任教師邱智宏
一般而言非揮性溶質的分子量可依 $$\Delta T=K_bm_B$$,的公式來求出。然而現今的實驗室鮮少使用此法求取物質的分子量,唯在教學上,基於依數性質的應用及探討,此部分的內容仍有其存在的必要。但是此法在使用上有一些限制,尤其僅適用於稀薄的溶液中,此點在一般課程內容中甚少提及,以下將此公式的推導及假設詳述一遍,以免遭到誤用。
一、沸點上升公式的推導
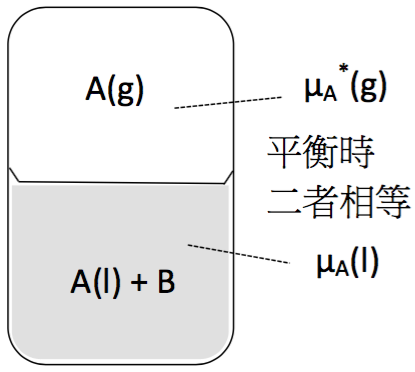
圖一 異相平衡中,B為非揮發性溶質,A為溶劑,A在氣相的化學能會等於其在液相的化學能
假設在理想溶液中,$$B$$ 為非揮發性(nonvolatile)溶質,$$A$$ 為溶劑如圖一所示,當系統達到平衡時,液相中 $$A$$ 的化學能($$\mu_A(l)$$)會等於氣相中 $$A$$ 的化學能($$\mu_A^*(g)$$),上標的 $$*$$ 代表其為純物質。
$$\mu^*_A(g)=\mu_A(l)~~~~~~~~~(1)$$
由熱力學的定律可知,相同狀況下,純溶劑的化學能永遠高於溶液的化學能,如下式所列,
其中 $$X_A$$ 代表溶劑的莫耳分率,其值小於 $$1$$,
故 $$\ln (X_A)<0$$。
$$\mu_A(l)=\mu^*_A(l)+RT\ln X_A~~~~~~~~~(2)$$