沸點上升法求分子量的限制(下)
沸點上升法求分子量的限制(下)
國立臺灣師範大學化學系兼任教師邱智宏
三、$$\ln(1-X_B)=-X_B$$誤差的探討
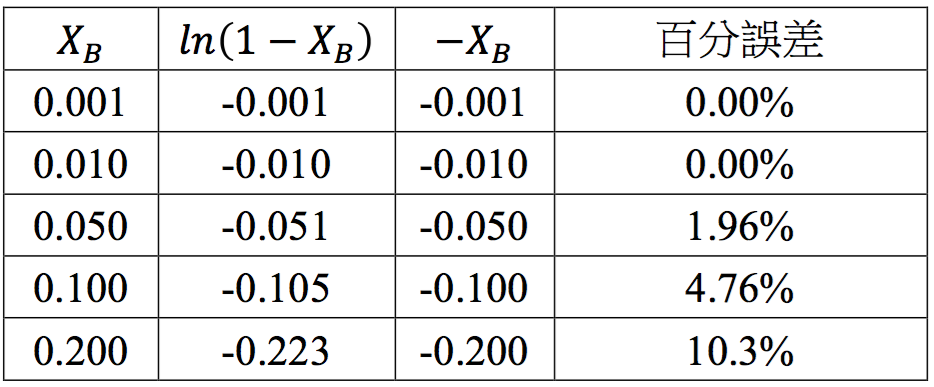
$$\ln(1-X_B)=-X_B$$ 成立的條件為 $$1\gg X_B$$,即溶質的莫耳分率遠小溶劑,為一稀薄溶液方能適用。如果我們直接將不同莫耳分率的 $$X_B$$ 直接經由計算機求出 $$\ln(1-X_B)$$ 的值,並比較其大小,如表二所示。
由表二可知,當 $$X_B$$ 為 $$0.001$$ 及 $$0.01$$ 時,$$\ln(1-X_B)$$ 和 $$-X_B$$ 幾乎相等,但 $$X_B$$ 為 $$0.05$$ 及 $$0.1$$ 時其百分誤差就分別增大為 $$1.96%$$ 及 $$4.76%$$。若為 $$0.20$$ 時其誤差便超過 $$10%$$。因此,溶質的莫耳分率在少於 $$0.05$$ 時,使用沸點上升法求溶質的分子量尚屬合理的範圍。
如果以苯為溶劑,若該溶質的莫耳分率為 $$0.05$$ 時,相當於重量莫耳濃度為 $$0.67m$$,算法如下:
據此溶劑(苯)的重量 $$=0.95\times 78.1~g=7.42\times 10^{-2}~kg$$
溶質的重量莫耳濃度 $$0.05~mol/7.42\times 10^{-2}~kg=0.67~m$$
四、結論
利用非揮發性的溶質能使溶液的沸點上升,經由以上對沸點上升公式($$\Delta T=K_b\cdot m_B$$)的推導過程中,可以到下列結果:
- 沸點上升常數僅與溶劑有關,而與非揮發性溶質的性質無關,其上升度數的多寡,亦僅與溶質的粒子數有關,至溶質是葡萄糖或蔗糖,其結果並没有差別。
- 不同溶劑的沸點上升常數不同,溶劑的分子量愈大或其沸點愈高,則沸點上升常數愈大。例如水的 $$K_b$$ 值為 $$0.52$$,遠小於苯及酚的 $$2.53$$ 及 $$3.04$$,因此在相同的莫耳分率下,後者沸點上升的度數較易測量。
- 使用沸點上升法時,若溶質的莫耳分率小於 $$0.05$$ 時,由於 $$\ln(1-X_B)=-X_B$$ 的假設尚能成立,所以不至於產生太大的誤差。若溶質的莫耳分率大於 $$0.1$$ 時,則此公式將無法適用。另外,整個公式的推導,尚假設在理想溶液中進行,若在真實溶液中誤差恐怕更大,因此,$$K_b$$ 透過理論計算,實不如直接使用實驗的經驗值來得準確。
- 非揮發性溶質也能使溶液的凝固點下降,其公式為:$$\Delta T=K_f\cdot m_B$$,整個公式的推導中,只需將式(3)中,溶劑在氣相的化學能($$\mu_A^*(g)$$)換成溶劑在固相的化學能($$\mu_A^*(s)$$)即可,其他步驟完全相同,唯 $$K_f$$ 稱為凝固點下降常數(cryoscopic constant)。當然其假設及使用上的限制,也和沸點上升法一樣。
- 雖然高中的教材或考試的題目,經常出現利用溶液的沸點上升,或凝固點下降以求溶質分子量的內容,除需留意溶質的濃度有使用上的限制,更應提醒學生,目前測分子量的技術已經日新月異,包括質譜儀、分子篩滲透層析儀等,現今的實驗室基本上已經不使用沸點上升法求分子量了。
參考資料
- P. W. Atkins, “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p. 134 (1994).
- 葉名倉,劉如熹,邱智宏,周芳妃,陳建華,陳偉民,高級中學化學選修上冊,南一書局,第140~141頁,2013 年。



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體 
