2s 軌域的能階為何比 2p 軌域低?
2s 軌域的能階為何比 2p 軌域低? Why is the 2s orbital lower in energy than the 2p orbital?
國立臺灣師範大學化學系兼任教授 邱智宏教授
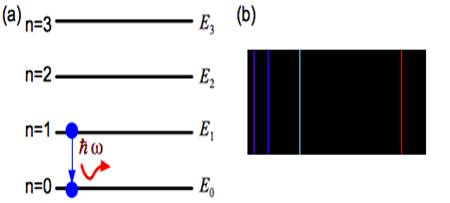
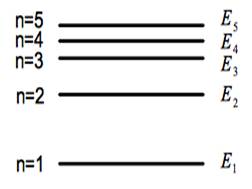
高中化學教授氫原子及多電子原子的軌域能階時,總會告訴學生氫原子 $$2s$$ 和 $$2p$$ 軌域的能階相等,而在多電子原子時則 $$2s$$ 軌域的能階比 $$2p$$ 低,至於為何會有這種現象,老師通常會說這是量子力學計算的結果,以後大家就會知道了。