比爾定律 (Beer’s Law)與吸收度 (Absorbance)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
比爾定律,又稱作比爾──朗伯定律(Beer-Lambert Law),是一個光學基礎定律。當光穿透樣品溶液時,光的吸收度 \((A)\) 與吸收係數 \((\alpha)\)、光徑長 \((l)\)、濃度 \((c)\) 三者均呈正比:\(A=\alpha lc\)
其中 \(\alpha\) 為吸收係數(absorptivity,或稱 absorption coefficient),亦可稱為消光係數(extinction coefficient, \(k\))。然而,若是在光徑長 \(b\) 使用了 cm 作為單位,並且濃度 \(c\) 使用 \(M\) 作為單位,吸收係數以 \(M^{-1}cm^{-1}\) 作為單位,那麼這時候的吸收係數,即可稱為莫耳吸收係數(molar absorptivity),其符號以 \(\varepsilon\) 來代表。莫耳吸收係數 \(\varepsilon\) 的使用相當頻繁,以至於還比吸收係數 \(\alpha\) 來的常出現。因此,常見的比爾定律表示方法為:\(A=\varepsilon bc\)
此外,我們需要瞭解的另一個重要定義是光的吸收度(absorbance)。當一束光線照射到一樣品溶液時,部份的光線會被樣品溶液吸收,剩下的光線則穿透樣品溶液,即原本光入射線強度 \(I_0\),穿透光線強度變為 \(I_1\),此時光的穿透度 \(T\) (Transmittance),即光穿透的比例為
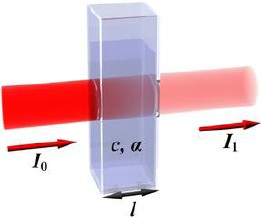
圖一、比爾定律吸收光路徑的示意圖。(圖片來源: WIKIPEDIA–Beer–Lambert law)