卡爾-費雪滴定
卡爾-費雪滴定 (Karl Fischer Titration)
國立臺灣師範大學化學系 林欣慧博士三年級
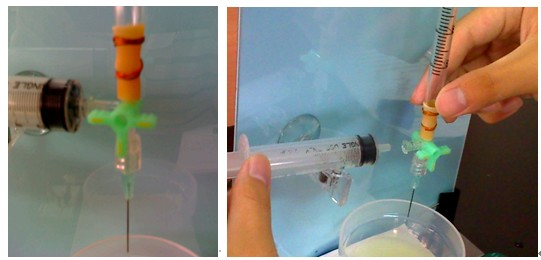
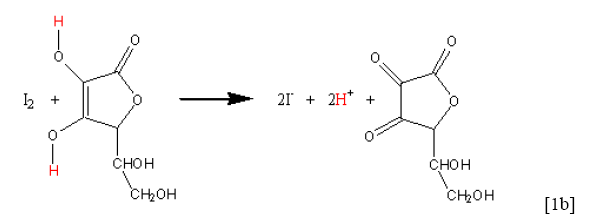
卡爾-費雪滴定 (Karl Fischer Titration) 是檢測物質所含微量水分的方法,卡爾∙費雪博士於 1935 年發表於 Angewandte Chemie 期刊,利用碘、二氧化硫與水進行氧化還原反應來偵測水的含量。此滴定法可應用在多種類的固體、有機液體的水分檢測,因此目前在工業界中檢測微量水分的方法都是利用此法。反應需在非極性的溶劑中進行,不可以在酸性或鹼性溶劑中,其主要反應式為式一。1,2
I2 + SO2 + 2H2O → 2HI +H2SO4 (式一)
而碘對水的化學計量會受到溶劑中的酸鹼影響,會由 1:2 變成 1:1,因此卡爾∙費雪博士為了穩定其劑量比及促使反應的平衡向右移動,在反應系統裡加入了吡啶 (pyridine) 做為緩衝以及使用無水甲醇作為反應溶劑。大量的吡啶可與碘及二氧化硫形成鹽類再與水進行反應,得到吡啶∙碘錯合物 (Pyridium iodide, C5H5N∙HI)、亞硫酸吡啶鹽 (Pyridium sulfite, C5H5N+∙SO–3)(式二)。