化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔III〕
化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔III〕
國立豐原高級中學化學科蔡亞柏老師/國立彰化師範大學化學系楊水平副教授責任編輯
連結:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔II〕
教師手冊(Teacher’s Guide)
兩點法深入說明
本實驗介紹兩點電位滴定法是大陸學者馮俊賢等人在Axel Johansson and Gunnar Gran的研究基礎上所提出滴定終點的判定方法,此法簡稱兩點電位法,有別於傳統電位滴定法的終點判定。同時此法也可適用其他類型的酸鹼滴定,如強鹼滴定強酸,以及氧化還原反應電位滴定。請參閱延伸閱讀中參考資料2~4。
若滴定過程不慎超過當量點,則無須進行反滴定,仍然可以使用兩點電位法繼續滴定。只需要在當量點之後,取兩組滴定數據(V1,pH1和V2,pH2)即可。然後利用[式9](在「學生講義之一」中描述),只需要取[式9]的△pH為負值(即△pH = pH1 – pH2),便可計算在當量點時所需NaOH標準溶液的體積(Ve)。換言之,在使用兩點電位法判定終點時,所選取兩組滴定數據必須在當量點同一側(當量點前或當量點後),並且儘量靠近當量點附近為取點原則。
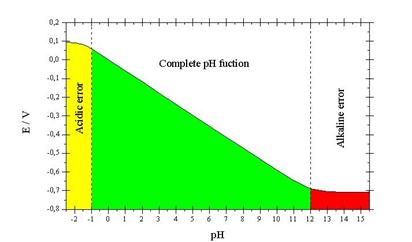
酸鹼度計工作原理
當酸鹼度計的pH複合電極置入待測溶液時,在其兩端會產生電動勢E。在pH = -1~12的範圍內,此電動勢E = a + bpH,如圖一所示。