化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔III〕
化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔III〕
國立豐原高級中學化學科蔡亞柏老師/國立彰化師範大學化學系楊水平副教授責任編輯
連結:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔II〕
教師手冊(Teacher’s Guide)
兩點法深入說明
本實驗介紹兩點電位滴定法是大陸學者馮俊賢等人在Axel Johansson and Gunnar Gran的研究基礎上所提出滴定終點的判定方法,此法簡稱兩點電位法,有別於傳統電位滴定法的終點判定。同時此法也可適用其他類型的酸鹼滴定,如強鹼滴定強酸,以及氧化還原反應電位滴定。請參閱延伸閱讀中參考資料2~4。
若滴定過程不慎超過當量點,則無須進行反滴定,仍然可以使用兩點電位法繼續滴定。只需要在當量點之後,取兩組滴定數據(V1,pH1和V2,pH2)即可。然後利用[式9](在「學生講義之一」中描述),只需要取[式9]的△pH為負值(即△pH = pH1 – pH2),便可計算在當量點時所需NaOH標準溶液的體積(Ve)。換言之,在使用兩點電位法判定終點時,所選取兩組滴定數據必須在當量點同一側(當量點前或當量點後),並且儘量靠近當量點附近為取點原則。
酸鹼度計工作原理
當酸鹼度計的pH複合電極置入待測溶液時,在其兩端會產生電動勢E。在pH = -1~12的範圍內,此電動勢E = a + bpH,如圖一所示。
使用酸鹼度計測定待測液之前,必須使用已知pH的標準緩衝溶液進行圖二線性關係的校正。通常,先使用pH 7.00的緩衝溶液,然後使用pH 4.00或/和pH 10.00的緩衝溶液進行校正,經過酸鹼度計中的微控制器進行定位及直線方程式迴歸,進而求出上述方程式中的a與b值。在校正之後,便可用測量待測溶液之 pH值。
由於校正的標準緩衝溶液的pH值會受溫度的影響,因此有些酸鹼度計有溫度補償,可修正溫度因素造成pH值的改變。
教學提示
● 上課時間:教師實驗解說:約20分鐘,學生自製小型電磁攪拌器:約20分鐘,學生實驗操作和數據記錄:約30分鐘。學生數據處理和回答問題(家庭作業或課堂討論):約30分鐘。若自製小型電磁攪拌器由教師組裝,可以節省上課時間約20分鐘。
● 本實驗可配合高三化學緩衝溶液、鹽類水解與酸鹼滴定的單元教學使用。提供不同於傳統酸鹼滴定終點的判斷方法,兩點電位法的化學原理適合高中學生的程度。學生自製小型電磁攪拌器可以融入生活科技課程和物理課程的教學中。
● 請教師提醒學生可預先以蒸餾水代替NaOH標準溶液,以熟練用PE滴管轉移NaOH標準溶液,及整個實驗的酸鹼滴定過程。
● 自製小型電磁攪拌器的轉速快慢,可透過調整電路中的可變電阻來完成。並以避免滴定時溶液外濺為原則。
藥品配製
● 0.100 M NaOH標準溶液可直接向化工原料行購得。
● 本次實驗的待測樣品食用醋可以使用透明度不佳的米醋(非白醋)。
數據記錄與處理樣本
1. 記錄NaOH標準溶液的真正濃度和待測食用醋的基本資料。
NaOH標準溶液的真正濃度: 0.100 M;
待測食用醋的廠牌和行號:大安工研食品工廠股份有限公司-工研醋 ;
待測食用醋所標示的濃度:4.5%以上 。
2. 記錄兩點法的實驗數據並數據處理於表一。
表一 兩點法的原始數據及當量點的體積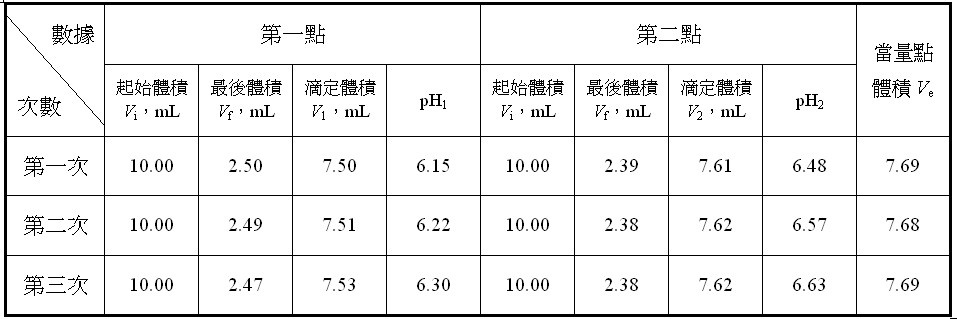 其中NaOH溶液滴定到當量點體積之Ve值是利用[式9]計算而得,△pH = pH2 –pH1。
其中NaOH溶液滴定到當量點體積之Ve值是利用[式9]計算而得,△pH = pH2 –pH1。
3. 計算三次在當量點時使用NaOH標準溶液體積的平均值 。
![]() = 7.69 mL + 7.68 mL + 7.69 mL = 7.69 mL
= 7.69 mL + 7.68 mL + 7.69 mL = 7.69 mL
4. 利用在當量點時酸和鹼的莫耳數相等,計算食用醋中醋酸的濃度(g/mL)。
酸的莫耳數 = 酸的重量 / 酸的莫耳質量
鹼的莫耳數 = 鹼的體積莫耳濃度 × 鹼使用的體積
亦即,酸的重量 / 酸的莫耳質量 = 鹼的體積莫耳濃度 × 鹼使用的體積
NaOH的莫耳數 = 0.100 M × 7.69 mL = 0.100 mmol/mL × 7.69 mL = 0.769 mmol
已知醋酸的莫耳質量為60.05 g/mol或60.05 mg/mmol。
醋酸的重量 = 0.769 mmol × 60.05 mg/mmol = 46.2 mg = 0.0462 g
由於被滴定的食用醋一次使用稀釋體積為20.0 mL且稀釋的濃度為原來濃度的1/20倍,
因此被滴定的食用醋一次使用原來濃度體積為20.0 mL × 1/20 = 1.00 mL。
故食用醋中醋酸的濃度為0.0462 g / 1.00 mL = 0.0462 g/mL。
5. 假設食用醋的密度為1.00 g/mL,此食用醋中醋酸的濃度為多少重量百分比?與廠商標示食用醋的濃度符合嗎?
食用醋中醋酸的濃度(重量百分比)為0.0462 g/mL × 1.00 g/mL × 100% = 4.62%。
待測食用醋的標示濃度為4.5%以上,與待測食用醋的標示濃度符合。
參考答案
1. 一般食用醋含3~5%的乙酸,濃度比較高。如果直接用於滴定,那麼會消耗大量的氫氧化鈉標準溶液,造成沒有必要的浪費。再者,消耗大量的氫氧化鈉標準溶液需要多次填充於量筒中,多次體積的加成會導致實驗的精確度下降。因此,食用醋要先稀釋後才進行酸鹼滴定。
2. 無法正確計算出食用醋中醋酸濃度。
因為計算食用醋中醋酸濃度需要用到在當量點時酸和鹼的莫耳數相等,亦即酸的重量 / 酸的莫耳質量 = 鹼的體積莫耳濃度 × 鹼使用的體積。若不知鹼的體積莫耳濃度(NaOH不是標準溶液),則無法得知酸的莫耳數及其重量,因此無法正確計算出食用醋中醋酸濃度。
3. 使用酸鹼指示劑作 為酸鹼滴定的終點判定,有些顏色深的待測樣品會干擾滴定終點的判定。有些實驗使用活性碳來吸附有顏色物質,以消除其對實驗的影響。不過,對於顏色很深的待 測樣品,吸附效果不大,還是有滴定終點判定的困難。再者,活性碳也會吸附有機酸,而造成實驗的負誤差。本次實驗採用兩點電位法,係使用酸鹼度計來讀取pH 值,不受待測樣品顏色的影響。
參考資料和延伸閱讀
1. Axel Johansson and Gunnar Gran, Automatic Titration by Stepwise Addition of Equal Volumes of Titrant Part V. Equivalence Volume in Acid-Base Titrations Extension of the Gran I Method for Calculation of the Equivalence Volume in Acid-Base Titrations, Analyst, 1980, 105, 802-810.
2. 林文如,酸鹼雙點電位滴定法,分析化學,1990,18 (7),633-637。
3. 馮俊賢,李素娟,鄭文娟等,兩點電位滴定法及應用,分析化學,2002,30(3),337-341。
4. 王勝碧,再論兩點電位滴定法在實驗教學中的應用,安順師範高等專科學校學報,2004,6(1),95-96。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  中間體與穩定狀態近似法
中間體與穩定狀態近似法  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 
