3D有趣實驗:美麗彩虹的消失(Disappearing Beautiful Rainbow)〔II〕
3D有趣實驗:美麗彩虹的消失(Chemical Whoosh Bottles)〔II〕
國立彰化師範大學化學系學生許紘齊 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「3D有趣實驗:美麗彩虹的消失〔I〕」
原理和概念
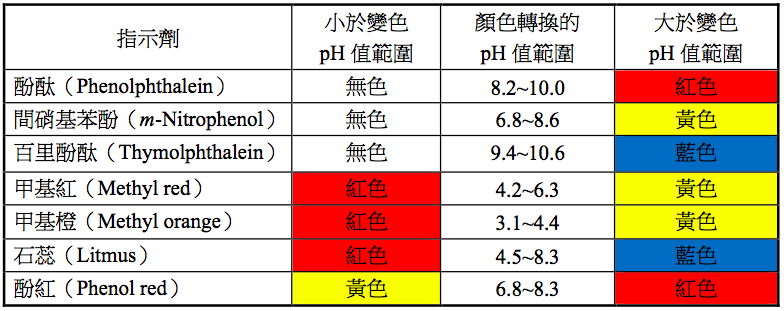
- 酸鹼指示劑的作用原理是當環境發生pH值改變時,自身的形態會改變,從而改變顏色,透過顏色的改變來指示滴定的終點。在滴定終點的附近,指示劑變色的過程中,會呈現出一種中間的顏色,處在這個過程中的範圍稱為指示劑的變色範圍。選擇指示劑的標準,一是變色範圍(包括終點),二是反應靈敏。也就是說,一種合適的指示劑在達到終點時必須很快的變色。常用的酸鹼指示劑之變色,如表一所示。
- 本實驗使用的酚酞(phenolphthalein)、間硝基苯酚(m –nitrophenol)和百里酚酞(thymolphthalein)三者皆為酸鹼指示劑,依照溶液環境的pH值的不同而顯現出不同的顏色,如表一所示的前三者。利用這些酸鹼指示劑的特性,在高pH值的環境下,溶液呈分別現出紅、黃、藍三種顏色。再藉由這三種指示劑之二種,以不同比例混合,使顏色混合呈現出橙(紅加黃:酚酞加間硝基苯酚)、綠(黃加藍:間硝基苯酚加百里酚酞)、紫(紅加藍:酚酞加百里酚酞)三種顏色。這三種指示劑具有共通點,就是在酸性環境中皆呈現無色。
- 乾冰(Dry Ice)是二氧化碳(carbon dioxide)的固體形式,二氧化碳略溶於水,容於水中隨之發生化學反應,產生碳酸(carbonic acid),如反應式[1]所示。碳酸與溶液中的氫氧化鈉反應,發生酸鹼中和,產生碳酸鈉,如反應式[2]所示。乾冰直接與氫氧化鈉反應,產生碳酸鈉,如反應式[3]所示。亦即,反應式[3]為反應式[1]和[2]之和。本實驗是透過乾冰的酸性,使溶液的pH值下降,進而使指示劑逐漸趨向無色。
CO2(g) + H2O(l) → H2CO3(aq) [1] H2CO3(aq) + 2NaOH(aq) → Na2CO3(aq) + H2O(l) [2] 2NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l) [3]