離子鍵
離子鍵 (Ionic bond)
國立臺灣師範大學附屬中學生蔡威任/國立臺灣師範大學附屬中學化學科陳昭錦老師
離子鍵為化學鍵的一種,它是由兩個相反電性的離子,藉由彼此間的靜電引力吸引而成。通常是由金屬元素(低游離能)形成陽離子而非金屬元素(高電子親和力)形成陰離子。單純的離子鍵是不存在的,在所有的離子化合物中都存有某些程度的共價鍵結,因此離子鍵可視為在鍵結中離子的特性大於共價的特性。當兩個原子間有較大的電負度差時,其鍵結的離子性就較大。
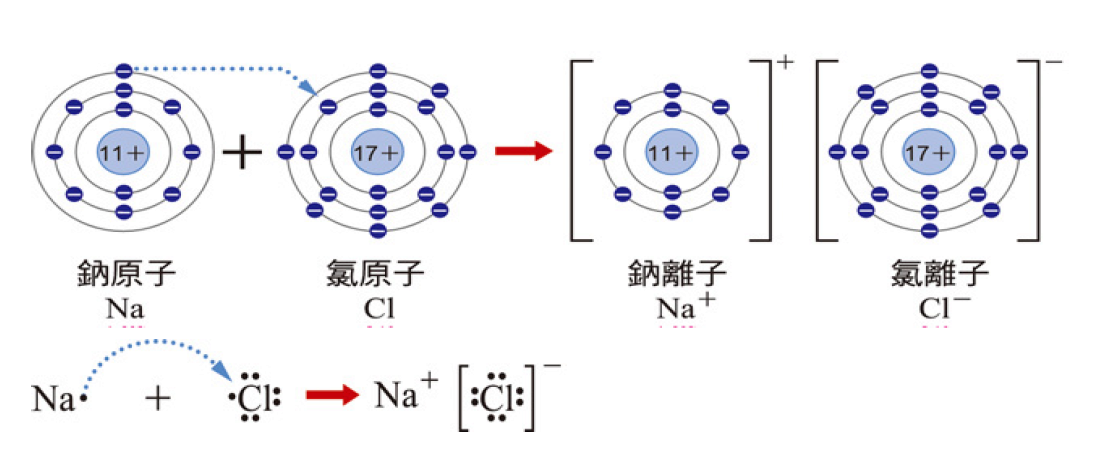
例如:我們生活中的必需品調味用的食鹽,其成份為氯化鈉,當鈉原子與氯原子要彼此結合時,鈉原子需先失去一個電子形成鈉離子,而氯原子需先獲得一個電子形成氯離子,這些離子們以1:1的方式形成氯化鈉晶體,其反應式為Na + Cl → Na+ + Cl− → NaCl。依據八隅體的概念,其反應情形可用圖一表示。
固態的離子化合物是以晶格的結構(lattice structures)方式存在,影響晶格的形成有離子電荷與尺寸大小兩個因素。