離子鍵
離子鍵 (Ionic bond)
國立臺灣師範大學附屬中學生蔡威任/國立臺灣師範大學附屬中學化學科陳昭錦老師
離子鍵為化學鍵的一種,它是由兩個相反電性的離子,藉由彼此間的靜電引力吸引而成。通常是由金屬元素(低游離能)形成陽離子而非金屬元素(高電子親和力)形成陰離子。單純的離子鍵是不存在的,在所有的離子化合物中都存有某些程度的共價鍵結,因此離子鍵可視為在鍵結中離子的特性大於共價的特性。當兩個原子間有較大的電負度差時,其鍵結的離子性就較大。
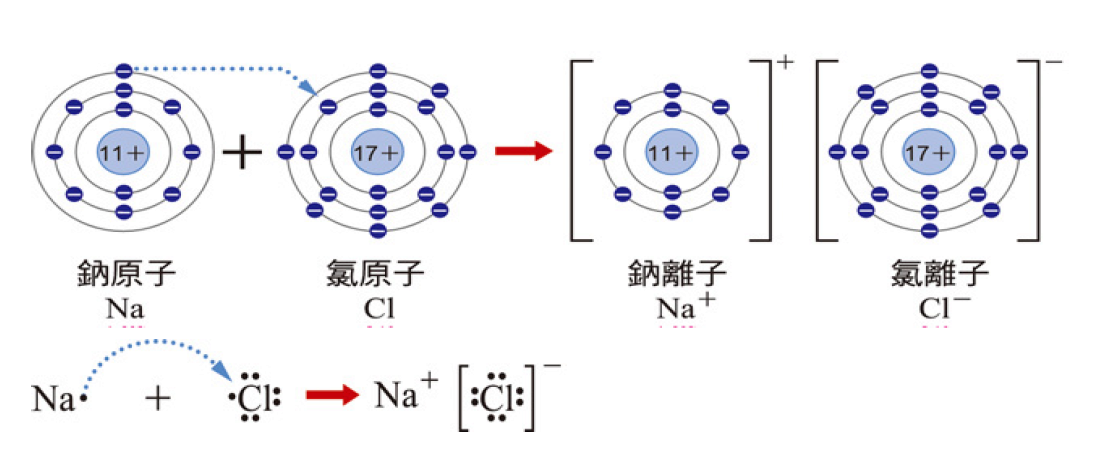
例如:我們生活中的必需品調味用的食鹽,其成份為氯化鈉,當鈉原子與氯原子要彼此結合時,鈉原子需先失去一個電子形成鈉離子,而氯原子需先獲得一個電子形成氯離子,這些離子們以1:1的方式形成氯化鈉晶體,其反應式為Na + Cl → Na+ + Cl− → NaCl。依據八隅體的概念,其反應情形可用圖一表示。
固態的離子化合物是以晶格的結構(lattice structures)方式存在,影響晶格的形成有離子電荷與尺寸大小兩個因素。
當異性電荷離子間距離愈小,離子電荷愈大,則離子間吸引力愈大,破壞離子鍵所需的能量也就愈大。例如: MgO的離子鍵強於NaCl(電荷因素),而NaF的離子鍵強於NaCl(離子間距離因素)。
由氣態離子彼此互相結合形成固態離子化合物的焓(Enthalpy)為晶格能(lattice energy),晶格能的實驗值可利用Born–Haber cycle來求得。也可以用Born–Landé equation來進行理論處理。
首先考慮距離為r電性相反的單一離子對,由庫侖定律其靜電吸引能量為:
上式中:z為離子電荷,e=1.6×10-19庫侖,= 1.112×10−10 C²/(J m)
於一個晶格中存在著許多類似一個離子對的簡單作用,以氯化鈉為例,其晶格中有6個最鄰近異性電荷的吸引力,12個次近同性電荷的排斥力…..等等作用力。這些幾何作用(geometrical interactions)的全部總和,即稱為Madelung常數,因此晶格中一對離子的能量即為:
式中M為Madelung常數,僅與結晶的幾何結構有關,而與離子半徑或電荷無關。
我們可由上式看出,需有排斥力存在,以平衡庫侖吸引力,否則無法得到穩定結晶。Born建議用下式表示這種排斥能量:
因此離子對的晶格能就可修正為:
再將其乘上亞佛加厥數可得一莫耳結晶的能量,以氯化鈉而言,其Born–Landé equation的計算值為-756KJ/mole,而Born–Haber cycle所得數值為-787KJ/mole。
參考資料:
1.離子鍵(Ionic bond)。檢索日期 2013.2.7, http://en.wikipedia.org/wiki/Ionic_bond。
2.James E.Huheey(1983). Inorganic chemistry:Principles of structure and reactivity. Prentice Hall.
3. 葉名倉主編 (民101),基礎化學(二)。南一書局,台南市。


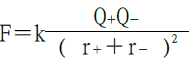
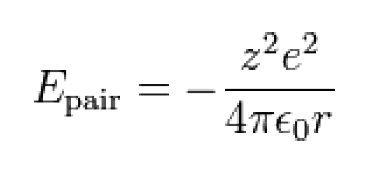
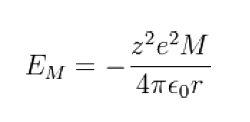
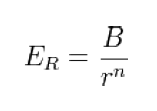
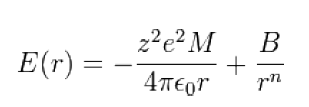
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破 
