鋅碳電池與鹼性電池
鋅碳電池 (Zinc-carbon Battery) 與鹼性電池 (Alkaline Battery)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
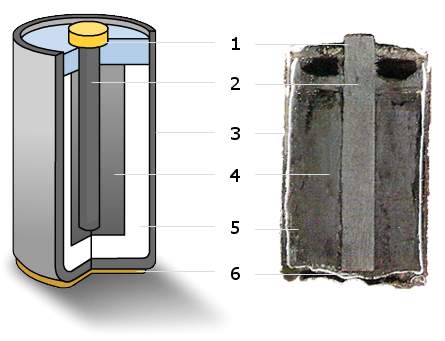
鋅碳電池,又稱鋅碳乾電池、碳性電池、碳性電芯,外殼由鋅構成。第一個商用乾電池是由法國科學家勒克朗社(G. Leclanché, 1839-1882)所發明,電池的陽極是鋅罐。陰極是一支碳棒(石墨棒),碳棒是惰性電極,只作為電子的通路,本身沒有直接參與化學反應。兩電極之間填滿了氯化銨(NH4Cl)為電解質、二氧化錳(MnO2)和氯化鋅(ZnCl2)的飽和溶液以及一些惰性漆料濕漿糊(圖1)。當電極被連接時,陽極的鋅即被氧化就失去電子(e–)。失去的電子便經由電線跑到陰極,使NH4Cl中解離出的NH4+離子還原成NH3,同時也形成氫氣。釋出的氫再被二氧化錳所氧化,而NH3則被利用形成錯合物Zn(NH3)2Cl2。
Zn(s) → Zn2+ (aq) + 2e–
陰電極上發生的還原作用:
2NH4+ (aq) + 2e– → 2NH3(aq)+H2(g) 2MnO2(s) + H2(g) → Mn2O3(s) + H2O(l)
鋅離子則與氨反應,生成錯合物:
Zn2+ (aq) + 2NH3(aq) + 2Cl–(aq) → Zn(NH3)2Cl2
電池內的整體反應:
2MnO2(s) + 2NH4Cl(aq) + Zn(s) → Zn(NH3)2Cl2 + Mn2O3(s) + H2O(l)
鋅碳電池的電壓為1.5 V,這種電池適用於只需少量電流的電器。此電池至少有兩個缺點,第一若電池放電太快便不能及時除去生成的氣體,令電壓減低,要暫停使用一會,電壓才能恢復到原來的水平;此外這種電池的壽命亦較短,這是因為除了鋅電極放電時會反應之外,電池在未使用時,酸性氯化銨也會與鋅電極發生作用。一段時間後鋅外殼會變薄,電池內的糊狀化學藥品便會泄出,因此在電池外常加上一層鋼製或膠製的外殼,防止與大氣作用,亦可防止糊狀化學藥品泄出。
當鋅碳電池的電能耗盡後,必須丟棄,難以再充電使用,其主要原因是鋅離子的標準還原電位比氫電極的標準還原電位還小(-0.76 V)之故,因此,若對鋅極充電,即施以負電壓時,氫離子會先於鋅離子接受電子而被還原成氫氣。由於氫氣是還原性氣體,若大量累積,可與MnO2或Mn2O3引起下列激烈氧化還原反應:
2 MnO2(s) + H2(g) → Mn2O3(s) + H2O(l) Mn2O3(s) + H2(g) → 2 MnO(s) + H2O(l)
因此,若冒然為鋅碳電池充電,將有爆炸之虞。有鑑於此一潛在危險性,電池製造商多於電池封皮加註警告標語以提醒用者。將鋅碳電池中的電解質氯化銨可以以氫氧化鉀(KOH)或氫氧化鈉(NaOH)鹼性溶液取代之,此類電池統稱鹼性電池。在放電過程中,因為陽極消耗電解質中的氫氧根離子,陰極則放出氫氧根離子,氫氧根離子的濃度維持不變,可得到比較穩定的電流與電壓。鹼性電池的壽命比上述的鋅碳乾電池長,這是因為鋅碳電池中鋅在酸性中會與酸反應生成鋅離子與氫氣而使鋅變薄;而在鹼性電池中,並不會有這種狀況發生。
鹼性電池的內的氧化還原反應式如下:
陽極: Zn(s) + 2OH–(aq) → ZnO(s) + H2O(l) + 2e–
陰極: 2e– + 2MnO2(s) + H2O(l) → Mn2O3(s) + 2OH–(aq)
總反應: Zn(s) + 2MnO2(s)→ZnO(s) + Mn2O3(s)
參考資料
1. Zinc–carbon battery.http://en.wikipedia.org/wiki/Zinc-carbon_battery
2. 電池的電極反應。 http://host6.wcjhs.tyc.edu.tw/~ta530010 … 4/a6-4.htm
3. Alkaline battery. http://en.wikipedia.org/wiki/Alkaline_battery


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 強化玻璃
強化玻璃  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義 

您對電池的介紹很詳盡,請同意轉載到我網站! 謝謝您!
親愛的讀者您好:
很感謝您的細心閱讀與支持
轉載是沒有問題的,只需註明出處即可。
高瞻 助理
敬上
[轉錄] 關於水晶電池
原文(簡体)
科技论坛 > 自由能源 > 关于水晶电池
http://www.tech-domain.com/thread-41022-1-1.html
youtube上有許多關於水晶電池(crystal battery)的視頻,製作非常簡單,具體做法是製作晶體結構,然後將銅作為正極,鐵作為負極,然後便可得到0.5~1V的電壓。可以製作為體積很小的電池,然後串聯起來能點亮功率很小的LED燈。
我做了幾個,很簡單,買點十二水矽酸鈉,買個小銅碗,裝進去,加熱讓其熔化,在中間放上鐵釘,待其結晶,矽酸鈉熔解後放入鐵釘會發生化學反應,之後矽酸鈉結晶反應就停止了。
發生化學反應時這玩意是個化學電池,但矽酸鈉結晶後仍然有電,功率很小,5~6個串起來就能把LED點亮。
電極的材料充分說明這是個化學電池,但是奇怪的是我試了第二種做法:買點速乾水泥,加水混合,放在銅片和鋁片之間,乾了以後這水泥電池能提供1V的電壓,如果把它加熱,功率大大增加,一個這玩意就可以把LED點亮。
問題來了,誰知道這是什麼原理?從電極看應該是化學反應,但是銅和鋁夾這水泥是怎麼發生的化學反應的?
第三種做法,成分為:明礬+硼砂
How to make a Dry Crystal Cell Battery that contains no Water
http://www.youtube.com/watch?v=8EWATxAJooE
鋅-銅電池 鉀離子之分佈
鋅-銅電池(若分別以硫酸鋅與硫酸銅做為電解質溶液),而鹽橋內裝的是硝酸鉀溶液。
請問在尚未通電時, 硝酸鉀溶液是否會滲透至正, 負極的溶液中? 硝酸根和鉀離子是否為均勻分布?
若是”會”, 那麼通電之後, 請問能否將鉀離子的分佈解釋為:
鉀離子在硫酸鋅溶液中逐漸減少, 而在硫酸銅溶液中逐漸增加?
這是我對段考一題答案的疑問, 他的正解是: 鉀離子的數量在硫酸鋅溶液中 “維持不變” , 而在硫酸銅溶液中逐漸增加…
他說”維持不變”的原因是因為本來硫酸鋅溶液內就沒有鉀離子, 而通電後也沒有, 因此數量不變(都是零)
……但是我們一般是用半透膜或棉花將鹽橋和兩杯水溶液作簡易的分隔, 因此不管怎樣尚未通電時的硫酸鋅溶液內也應該會有鉀離子吧~
請幫助我解決這個問題, 十分感謝!
內容有誤鋅皮是負極,碳棒正極