酸鹼滴定
酸鹼滴定(Acid-Base Titration)
臺北縣私立淡江高級中學化學科賴亭吟老師/國立臺灣大學化學系陳藹然博士責任編輯
滴定是將已知濃度的標準溶液滴入已知體積的被測溶液中,待反應達終點(指示劑變色)後,利用標準溶液消耗的體積,計算被測溶液的濃度。
酸鹼滴定時,當酸所消耗氫離子莫耳數等於鹼所消耗氫氧根離子莫耳數,此時稱為當量點(equivalent point)。而在滴定過程中,指示劑變色時稱為滴定終點(endpoint)。因為指示劑的變色為一漸進過程,有一定的pH範圍,故滴定終點和當量點不一定相同,但只要選擇合適的指示劑,通常可將滴定終點視為當量點。
滴定過程中,將滴定溶液之體積與待測溶液之pH值繪圖,稱為滴定曲線。由滴定曲線不僅可看出滴定時溶液pH值的變化方向與各個階段的變化速度,也可藉由滴定曲線找出合適的指示劑。最理想的指示劑應該能恰好在當量點時發生顏色變化,也就是使滴定終點剛好為當量點,但實際上卻很難使兩點恰為同ㄧ點。因此指示劑的選擇,主要以滴定過程中,pH值變化最大的範圍為依據,選取變色範圍全部或部分處在此範圍內的指示劑,此時的滴定終點與當量點產生的誤差不會超過±0.1%。
酸鹼滴定可依酸鹼強弱之不同,分為強酸強鹼滴定、強酸弱鹼或強鹼弱酸滴定、弱酸弱鹼滴定等三種滴定,前兩者分別介紹如下:
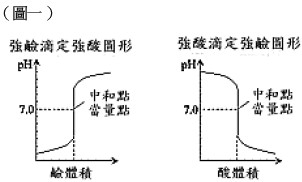
1. 強酸強鹼滴定
例如氫氧化鈉與鹽酸的滴定,反應方程式如下:
HCl + NaOH → NaCl + H2O
達到當量點時,滴定溶液中所存在的是由強酸和強鹼所形成的鹽NaCl,因此pH值等於7,又可稱為中和點。
滴定曲線如下圖所示,在當量點前後,只要滴定溶液ㄧ點點的體積變化就能使pH值變化甚大。因此對於強酸強鹼滴定,可選擇的指示劑變色範圍很廣,幾乎任何指示劑都可適用。例如甲基橙 (pH 3.1-4.4) 和酚酞 (pH 8.0-10.0) 的變色範圍均有一部分在pH值變化最大的範圍內,因此都可用來最為指示劑,其他如甲基紅、溴瑞香草酚藍和溴百里酚藍等也可用作這類滴定的指示劑。
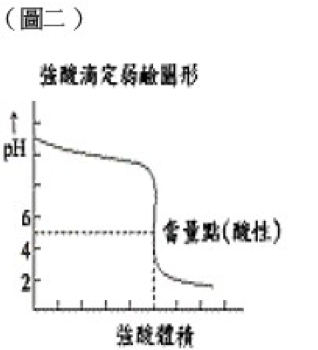
NaOH + CH3COOH → CH3COONa + H2O達到當量點時,滴定溶液中存在的是由弱酸及強鹼所形成的鹽 CH3COONa,呈鹼性。因此弱酸強鹼滴定僅可選擇變色範圍大於pH值為7的指示劑,最常使用如酚酞。
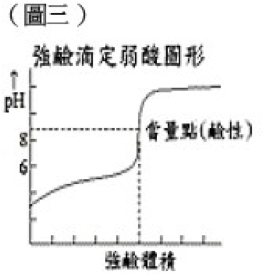
由於酸鹼滴定有操作簡便,分析速度快和結果準確等優點,因此在應用上十分廣泛,如測定食物的酸度、胃藥的檢驗等。
參考資料
1. http://www.dfmg.com.tw/member/aux-d/tb00-2k2a.htm
2. http://www.all4you.com.tw/web3/vip/tips/026_c/right_2.htm(滴定曲線圖)
3. http://www.med126.com/edu/200708/14229.html


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
