純物質相對熵的求法-以SO2為例(二)
純物質相對熵的求法-以SO2為例(二)
The method to obtain relative entropy of pure substance – a case study in SO2 (II)
國立臺灣師範大學化學系兼任教師 邱智宏
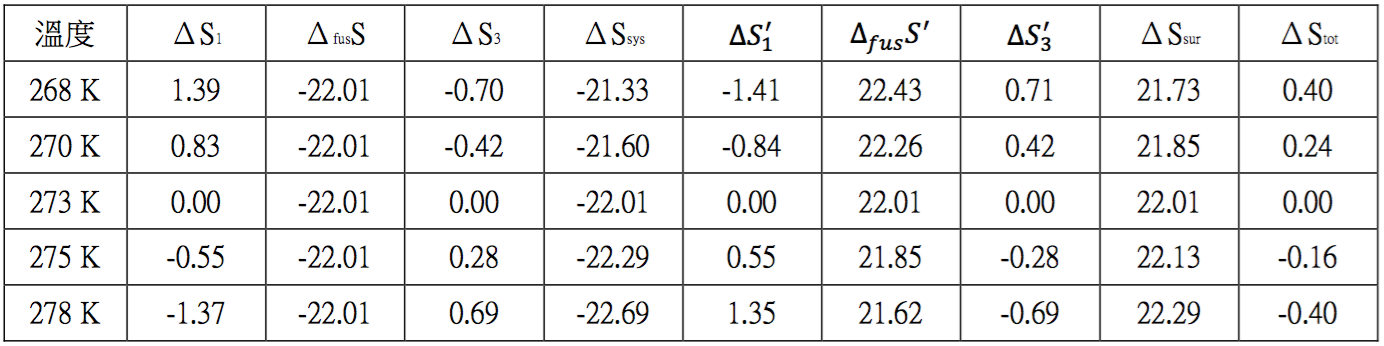
(二)熔點及沸點時其熵值變化量的求法
由實驗得知,$$\mathrm{SO_2}$$ 的熔解熱及蒸發熱分別為 $$1769$$、$$5960~cal/mol$$,熔點及沸點分別為 $$197.64$$ 及 $$263.1~K$$,將這些數據代入 $$(2)$$ 式的相對應式子中,便可求出熔點及沸點時的熵值變化:
$$\displaystyle \frac{\Delta_{fus}H^\circ_m}{T_m}=\frac{1769}{197.64}=8.95~cal\cdot mol^{-1}K^{-1}=37.41~J\cdot mol^{-1}K^{-1}~~~~~~~~~(7)$$
$$\displaystyle \frac{\Delta_{vap}H^\circ_m}{T_b}=\frac{5960}{263.1}=22.65~cal\cdot mol^{-1}K^{-1}=94.69~J\cdot mol^{-1}K^{-1}~~~~~~~~~(8)$$