熔點以下的水會自發性結成冰的原因-環境熵和系統熵一樣重要(二)
熔點以下的水會自發性結成冰的原因-環境熵和系統熵一樣重要(二)
The reason of water would spontaneously turn into ice when the temperature is below the melting point – the surrounding entropy is as important as system entropy (II)
國立臺灣師範大學化學系兼任教師 邱智宏
二、不同室溫下,溫度和室溫相等的水會安定存在或轉變成冰
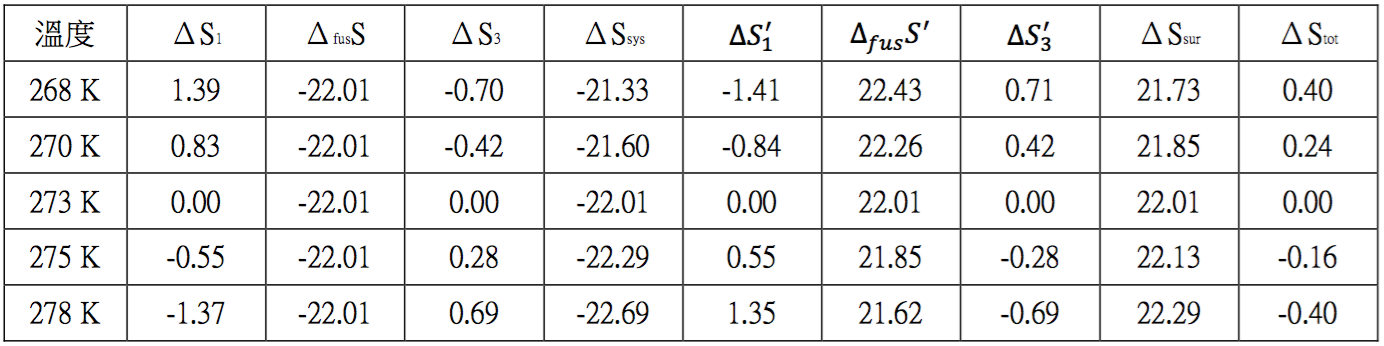
由上面的例題得知,常壓下,室溫為 $$-5^\circ C$$ 時,水會自發性的轉變為 $$-5^\circ C$$ 的冰,如果將室溫提高為$$x^\circ C$$,則 $$x^\circ C$$ 的 $$\mathrm{H_2O}$$ 應該會以水的形式存在?或是以冰的形式存在?我們以上例相同的計算方式,分別計算室溫變為 $$-5$$、$$-3$$、$$0$$、$$2$$、$$5^\circ C$$ 時,各步驟中系統熵和環境熵的變化,其結果詳如表一。
由表一可看出當室溫為 $$270~K(-3^\circ C)$$ 時,其 $$\Delta S_1$$ 相對於 $$268~K$$ 時的 $$1.39$$ 減少,變為 $$0.83$$,即系統由 $$270~K$$ 上升至 $$273~K$$ 時所吸收的熱量,比由 $$268~K$$ 上升至 $$273~K$$ 時來得少的緣故。
$$\Delta_{fus}S$$ 不變,$$\Delta S_3$$ 則由 $$268~K$$ 時的 $$-0.70$$ 升高為 $$-0.42$$。三者相加後,系統熵的總和減少,由 $$-21.33$$ 成為 $$-21.60$$。同時,環境熵則些微增加,由 $$21.73$$ 成為 $$21.85$$,但兩者相加的整體熵仍為正值,即 $$+0.24$$,代表 $$-3^\circ C$$ 的水仍會自發性的轉變為冰。
如果以相同的方式計算,只要室溫在水的熔點以下$$ (273~K)$$,$$0^\circ C$$ 以下的水均會自發性的轉變為冰,但隨著溫度的升高,其正值愈小。當溫度恰等於水的熔點時,此時整體熵的變化量為 $$0$$,代表此時兩相共存,水會變成冰,冰也會變成水。若室溫上升至 $$+5^\circ C$$ 時,此時整體熵成為負值,為 $$-0.40$$,代表此時的水不但不會轉變為冰,反而是其逆反應,冰會自發性的變為 $$5^\circ C$$ 的水。
由上面的討論可知,當室溫和系統的溫度均低於 $$0^\circ C$$ 時,水會自動凝結成冰,相反地,若高於 $$0^\circ C$$ 時,冰會自動熔化成水,亦即在常壓下不可能存在 $$-5^\circ C$$ 的水和 $$+5^\circ C$$ 的冰。但是在高壓的情況下,則情況又有所不同,由圖二水的相圖中可以看出(其縱軸為指數座標),在壓力為 $$1~bar (100~kPa,0.987~atm)$$ 附近很寬廣的範圍內,確實看不到 $$-5^\circ C$$ 的水和 $$+5^\circ C$$ 的冰。但是在壓力很大時,譬如為 $$100~Mpa$$ 附近,便能看到 $$-5^\circ C$$ 的水,若在更高的壓力下,例如 $$1~Gpa$$ 以上時便能看到 $$+5^\circ C$$ 以上的冰。

圖二$$~~~$$水的相圖,$$Y$$ 軸使用對數座標。$$-5^\circ C$$ 的水必需在壓力為 $$100~MPa$$ 時才能穩定存在,而 $$5^\circ C$$ 的冰則要 $$1~GPa$$ 才能存在。(來源:參考資料2)
由右式:$$\Delta_{tot}S=\Delta_{sur}S+\Delta_{sys} S$$ 可知,判斷一個反應能不能進行?需同時考慮系統和環境熵的變化量,但事實上亦可以只觀注在系統上,因為環境所吸或放的熱量 $$(\Delta H_{sur})$$,相當於系統所吸或放熱量的負值 $$(-\Delta H_{sys})$$,因此上式可改寫成:
$$\begin{array}{ll}\Delta S_{tot}=\Delta S_{sys}-\frac{\Delta H_{sys}}{T}&\Rightarrow T\Delta S_{tot}=-\Delta H_{sys}+T\Delta S_{sys}\\&\Rightarrow -T\Delta S_{tot}=\Delta H_{sys}-T\Delta S_{sys}\end{array}$$
事實上 $$-T\Delta_{tot}S$$ 相當於系統的自由能 (Gibbs free energy,$$\Delta G$$),整體熵的變化量大於 $$0$$,相當於系統的自由能小於 $$0$$,兩者均為系統能自發反應的表徵。
三、結論
透過日常生活中顯而易見的例子,水在常壓下,不同室溫時,何時會結冰的簡單推導,使熱力學的計算和生活經驗得以相互印證。由 $$-5^\circ C$$ 水到 $$-5^\circ C$$ 冰的變化過程中,透過系統熵和環境熵的計算,得知兩者的總和,即整體熵是否大於 $$0$$,才是判斷反應是否會自發性進行的關鍵,而不是單由系統熵的變化量來決定。
由計算中可知,常壓下,室溫在水的熔點以下,不可能存在低於熔點的水,既使有也會自發性的凝結為冰。相同的,室溫在水的熔點以上,不可能存在高於熔點的冰,既使有也會自發性的熔化為水。但是若不在常壓的情況下,則可能有 $$-5^\circ C$$ 的水和 $$+5^\circ C$$ 的冰。另外,若室溫等於水的熔點時,整體熵的變化量為 $$0$$,此時液、固兩相共存,由於此時圖一系統中的路徑 Ι,變為可逆程序,整體熵的計算便不需要分成三步驟,便能直接計算出來。最後,討論整體熵時,需同時觀注系統和環境,若改由觀察自由能時,便能只處理系統內的變化,唯前者的數值大於 $$0$$ 時會自發反應,而後者恰好相反。
參考文獻
- Heat capacity — Wikipedia. http://en.wikipedia.org/wiki/Heat_capacity
- Triple point — Wikipedia. http://en.wikipedia.org/wiki/Triple_point
- Atkins, P. W. (1994) Physical Chemistry, Oxford University Press, Oxford, 5th ed., p. 119~159


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  強化玻璃
強化玻璃  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定 
